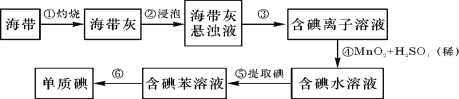
题目内容
【题目】(1)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸.按要求回答下列问题:
①电工操作上规定:不能把铜导线和铝导线连接在一起使用.请用电化学知识说明原因 .
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? 能 (填“能”或“不能”),若能,请写出电极反应式, .
③若用石墨作电极,电解1L0.1mol/L盐酸,当转移0.5mol电子时,阳极得到气体的体积(标况)为 L.
(2)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
①写出氢氧燃料电池工作时正极电极反应方程式: .
②如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下氧气 .
③若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 .

【答案】(1)形成原电池加速铝导线的腐蚀;能;负极:Cu﹣2e﹣=Cu2+;正极:2Fe3++2e﹣=2Fe2+;3.36;(2)O2+2H2O+4e﹣=4OH﹣;0.56L;CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O.
【解析】解:(1)①铜、铝的金属活泼性不同,遇到合适的电解质溶液易构成原电池,从而加快铝的腐蚀,所以不能把铜导线和铝导线连接在一起使用,
故答案为:形成原电池加速铝导线的腐蚀;
②铜、石墨的活泼性不同且都导电,铜和硫酸铁能自发的进行氧化还原反应,所以铜、石墨、硫酸铁溶液能构成原电池,铜易失去电子发生氧化反应,所以铜作负极,石墨作正极,负极上的电极反应式为:Cu﹣2e﹣=Cu2+,正极上铁离子得电子发生还原反应,电极反应式为2Fe3++2e﹣=2Fe2+,
故答案为:能;负极:Cu﹣2e﹣=Cu2+;正极:2Fe3++2e﹣=2Fe2+;
③若用石墨作电极,电解1L0.1mol/L盐酸,阳极上的反应2Cl﹣﹣2e﹣=Cl2↑,4OH﹣﹣4e﹣=O2↑+2H2O,阴极上的电极反应为:2H++2e﹣=H2↑,全部氯离子失电子总量是0.1mol生成氯气是0.05mol,失去0.4mol电子得到氧气的物质的量是0.1mol,当转移0.5mol电子时,阳极得到气体是氯气0.05mol,氧气0.1mol,所以当转移0.5mol电子时,阳极得到气体的体积(标况)为0.15mol×22.4L/mol=3.36L,故答案为:3.36;
(2)①写出氢氧燃料电池工作时正极是氧气放电,生成氢氧根离子,正极电极反应方程式:O2+2H2O+4e﹣=4OH﹣,故答案为:O2+2H2O+4e﹣=4OH﹣;
②消耗1mol的氧气转移,4mol电子,所以每转移0.1mol电子,消耗氧气的物质的量为:![]() mol=0.025mol,所以体积为:0.025mol×22.4L/mol=0.56L,故答案为:0.56L;
mol=0.025mol,所以体积为:0.025mol×22.4L/mol=0.56L,故答案为:0.56L;
③甲烷和氧气为原料进行工作时,负极甲烷发生氧化反应,碱性条件下,甲烷燃烧生成碳酸根离子,其电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;故答案为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O.