��Ŀ����
����Ŀ��ij��ѧ��ȤС��ͬѧչ����Ư����������(NaClO2)���о���
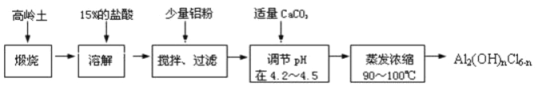
ʵ����. ��ȡNaClO2����
��֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2��3H2O������38��ʱ�����ľ�����NaClO2������60 ��ʱNaClO2�ֽ��NaClO3��NaCl����������ͼ��ʾװ�ý���ʵ�顣

(1) װ�����в���ClO2����Ļ�ѧ����ʽΪ ��
װ�������Ʊ�NaClO2�Ļ�ѧ����ʽΪ ��
(2) װ������������ ��
(3) ��װ������Ӧ�����Һ���NaClO2����IJ����������£�
����ѹ��55�������ᾧ�������ȹ��ˣ��� ��������60 ������õ���Ʒ��
ʵ��II. �ⶨij����������Ʒ�Ĵ���
�������ʵ�鷽����������ʵ�飺
����ȡ��������������Ʒm g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ(��֪��ClO2+4I+4H+==2H2O+2I2+Cl)�������û��Һ���250 mL������Һ��
����ȡ25.00 mL������Һ����ƿ�У��Ӽ��ε�����Һ����c mol��L1 Na2S2O3��Һ�ζ������ζ��յ㡣�ظ�2�Σ����ƽ��ֵΪV mL(��֪��I2+2S2O32=2I+S4O62)��
(4) �ﵽ�ζ��յ�ʱ������Ϊ ��
(5) ����Ʒ��NaClO2����������Ϊ (�ú�m��c��V�Ĵ���ʽ��ʾ)��
(6) �ڵζ�������ȷ���������£���ʵ���ý��ƫ�ߣ�ԭ�������ӷ���ʽ��ʾΪ ��
���𰸡�
(1)2NaClO3+Na2SO3+H2SO4==2ClO2��+2Na2SO4+H2O
2NaOH+2ClO2+H2O2==2NaClO2+2H2O+O2
(2)��ֹ����
(3)��38��60������ˮϴ��
(4)��Һ����ɫ��Ϊ��ɫ����30s�ڲ���ɫ
(5)![]() %(6)4I-+O2+4H+==2I2+2H2O
%(6)4I-+O2+4H+==2I2+2H2O
��������
�����������1���������ƾ��л�ԭ�����ڷ�Ӧ������ԭ����װ�����в���ClO2�ķ�Ӧ����������������Һ��������������Ϊ����������������ԭΪ������������Ӧ�Ļ�ѧ����ʽΪ��2NaClO3+Na2SO3+H2SO4=2ClO2��+2Na2SO4+H2O��װ������Ӧ�����Һ���NaClO2��������װ����������NaClO2��ClԪ�صĻ��ϼ۽�����˫��ˮӦ���ֻ�ԭ�������������������ԭ���غ��֪������ˮ��������ƽ��ʽΪ��2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2����2��װ�����ǰ�ȫƿ�ܷ�ֹ�������ʴ�Ϊ����ֹ��������3������Һ����ȡ������һ����������ᾧ�����ˡ�ϴ�ӡ�����ķ�����Ϊ��ֹ��������NaClO2��3H2O��Ӧ���ȹ���������Ŀ��Ϣ��֪��Ӧ�����¶�38����60������ϴ��������60���������ʴ�Ϊ����38����60����ˮϴ������4���������۱���ɫ����Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��Na2S2O3��Һʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ����ʴ�Ϊ���μ����һ��Na2S2O3��Һʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ�����5������Ʒ��NaClO2����������Ϊa������
NaClO2��2I2��4S2O32-
90.5g 4mol
mag c mol��L-1��V��10-3L��![]() ��
��
����90.5g��mag=4mol��c mol��L-1��V��10-3L��![]() ��
��
���a=![]() %=
%=![]() %���ʴ�Ϊ��
%���ʴ�Ϊ��![]() %��
%��
��6��ʵ���ý��ƫ����˵���ζ����ĵ�Na2S2O3��Һ���ƫ������Һ�е�ĺ���ƫ����Ӧ�����ɵĵ����ӱ���������Ϊ����ͬʱ����ˮ����Ӧ���ӷ���ʽΪ4I-+O2+4H+=2I2+2H2O��
�ʴ�Ϊ��4I-+O2+4H+=2I2+2H2O��