题目内容
【题目】二氧化碳的有效回收利用,既能缓解能源危机,又可减少温室效应的影响,具有解决能源问题及环保问题的双重意义。Zn/ZnO热化学循环还原CO2制CO的原理如下图所示,回答下列问题:

(1)①从循环结果看,能量转化的主要方式是______________ ;
②反应2CO2(g)=2CO(g)+O2(g) △H=_________kJ/mol。
③Zn/ZnO在反应中循环使用,其作用是__________________
(2)二甲醚是主要的有机物中间体,在一定条件下利用CO2与H2可直接合成二甲醚:2CO2(g) +6H2(g)![]() CH3OCH3(g)+3H2O(g) ,
CH3OCH3(g)+3H2O(g) ,![]() =3时,实验测得CO2的平衡转化率随温度及压强变化如下图所示。
=3时,实验测得CO2的平衡转化率随温度及压强变化如下图所示。
①该反应的△H =______0(填“>”或“<”)。
②图中压强(P)由大到小的顺序是__________________。
③若在1L密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率对应下图中A点,则在此温度,该反应的化学平衡常数是___________(保留整数)。
④合成二甲醚过程中往往会生成一氧化碳,合成时选用硅铝化合物做催化剂,硅铝比不同时,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如下图所示。图中A点和B点的化学平衡常数比较:KA____KB(填“>、<、=”)。根据以上两条曲线,写出其中一条变化规律:_______________________。

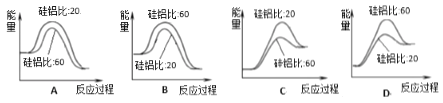
⑤上图是使用不同硅铝比化合物做催化剂制备二甲醚的能量变化示意图,其中正确且最佳的是__________。
【答案】太阳能转化为化学能 564 催化剂 < p1>p2>p3 23 = a.温度越高,二甲醚的选择性越大;b.低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小 A
【解析】
(1)①仔细分析图象可知在太阳能的作用下实现了反应,2CO2(g)=2CO(g)+O2(g),所以实现了太阳能向化学能的转化;
②利用盖斯定律进行计算将已知两个热化学方程式相加后再乘以2即得:2CO2(g)=2CO(g)+O2(g) △H=+564kJ/mol;
③Zn/ZnO在反应中循环使用,反应中起到催化剂的作用;
(2)①依据图象,随温度升高,CO的转化率降低,确定反应为放热反应,△H<0;
②2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)正反应为气体分子数减小的反应,温度一定时,压强越大,CO2的转化率越大,根据图象温度相同时CO2的转化率:p1>p2>p3,则图中压强由大到小的顺序为p1>p2>p3;
③根据A点,利用三段式法计算平衡常数;
2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)
起始量(mol/L) 0.2 0.6 0 0
反应量(mol/L) 0.1 0.3 0.05 0.15
平衡量(mol/L) 0.1 0.3 0.05 0.15
K=![]() ≈23;
≈23;
④平衡常数只受温度影响,图中280℃下的A点和B点的平衡常数相等;从图中两条曲线的变化趋势及对比情况可以看出:230℃的曲线变化相对平缓,280℃的曲线变化程度较大且先升后降,280℃二甲醚物质的量分数较大,温度升高,二甲醚的物质的量浓度的变化受影响的程度也有所改变等,因此可以概括为:a.温度越高,二甲醚的选择性越大;b.低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小;
⑤使用不同硅铝比化合物做催化剂制备二甲醚,反应为放热反应,催化剂能够降低反应的活化能,加快反应速率,但化学平衡不发生移动和反应的焓变也不改变,图象中只有A符合。

 优学名师名题系列答案
优学名师名题系列答案【题目】下列是典型晶体的结构示意图,从①到⑥对应正确的是:
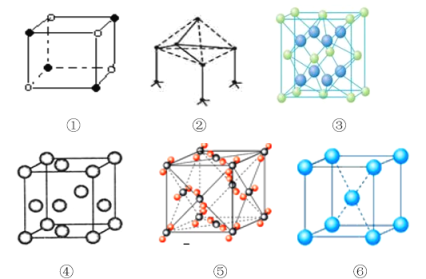
选项 | ① | ② | ③ | ④ | ⑤ | ⑥ |
A | NaCl | 单质硅 | CaF2 | Au | CO2 | K |
B | CaF2 | SiC | 金刚石 | Cu | CO2 | CsCl |
C | CsCl | 金刚石 | CaF2 | Cu | CO2 | Mg |
D | NaCl | BN | Au | CaF2 | CO2 | Na |
A. A B. B C. C D. D







