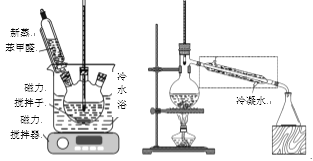
��Ŀ����
����Ŀ��1807�껯ѧ�Ҵ�ά����������������Ƶ��ƣ�4NaOH(����)![]() O2��+4Na+2H2O��������������������������������������Ҳ�Ƶ��ƣ�3Fe+4NaOH=Fe3O4+2H2��+4Na���������й�˵����ȷ����
O2��+4Na+2H2O��������������������������������������Ҳ�Ƶ��ƣ�3Fe+4NaOH=Fe3O4+2H2��+4Na���������й�˵����ȷ����
A. ��ά�����ƣ������ĵ缫��ӦʽΪ��Na++e-=Na��
B. ���������˷�����ԭ�����������Ľ����Ա��Ƶ�ǿ
C. ���ô�ά������������˷��Ƶõ������ƣ�������ת�Ƶ����������
D. �������õ�������Ȼ��Ʒ�����
���𰸡�D
��������
A.��ά�����ƣ������ĵ缫��ӦʽΪ��Na++e-=Na����������OH-ʧȥ���ӣ�����������Ӧ���缫��ӦʽΪ4OH--4e-=2H2O+ O2����A����
B.������Naǿ��Fe�����������˷�����ԭ���Ǹ����Ƶķе�ϵ͡��״ӷ�Ӧ������з���������Ӷ�ʹ��ѧƽ���������ƶ���B����
C.���ݷ�Ӧ����ʽ��֪�ô�ά����ȡ�����ƣ�ÿ��Ӧ����4molNaת�Ƶ��ӵ����ʵ�����4mol�����ø��������˷��Ƶ�4mol���ƣ�ת�Ƶ��ӵ����ʵ�����8mol�������ȡ�����Ľ����ƣ�ת�Ƶ��ӵ����ʵ�������ȣ�C����
D.����NaCl�����ӻ����NaCl����Ȼ�纬���ḻ������ڹ�ҵ�Ͽ��õ�������Ȼ��Ƶķ����ƽ����ƣ�D��ȷ��
�ʺ���ѡ����D��