题目内容
9.用NA表示阿伏加德罗常数,下列说法中正确的有( )| A. | pH=13的NaOH溶液中含有的OH-的数为0.1 NA | |
| B. | Fe在少量Cl2中燃烧生成0.5 mol 产物,转移的电子数为1 NA | |
| C. | 18g D2O中含有的质子数为9NA | |
| D. | 标准状况下,含4 mol HCl的浓盐酸与足量MnO2加热反应可生成22.4 L氯气 |
分析 A、溶液体积不明确;
B、根据铁与氯气反应后变为+3价来分析;
C、求出重水的物质的量,然后根据1mol重水中含10mol质子;
D、二氧化锰只能与浓盐酸反应,一旦盐酸变稀,反应即停止.
解答 解:A、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故A错误;
B、铁与氯气反应后变为+3价,故当有0.5mol氯化铁生成时,即有0.5mol铁参与反应,则转移1.5mol电子,即1.5NA个,故B错误;
C、18g重水的物质的量n=$\frac{18g}{20g/mol}$=0.9mol,而1mol重水中含10mol质子,故0.9mol重水中含9mol质子,即9NA个,故C正确;
D、二氧化锰只能与浓盐酸反应,一旦盐酸变稀,反应即停止,故4molHCl不能完全反应,则生成氯气的物质的量小于1mol,即体积小于22.4L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
14.关于下列各实验装置图的叙述中,不正确的是( )
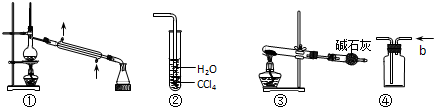

| A. | 装置①常用于分离某些互溶的液体混合物 | |
| B. | 装置②可用于吸收HCl气体,并防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于实验室制备少量NH3 | |
| D. | 装置④b口进气,可用排空气法收集H2、NO等气体 |
20.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1NaHC2O4溶液与0.1mol•L-1KOH溶液等体积混合,所得溶液中:c(Na+)>c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-) | |
| B. | 20mL 0.1 mol•L-1 NH4Cl溶液与10mL 0.1mol•L-1NaOH溶液混合后溶液呈碱性,所得溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下,pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:c(Na+)+c(OH-)>c(H+)+c(F-) | |
| D. | 0.1mol•L-1 NH3•H2O溶液与0.1mol•L-1HNO3等体积混合,所得溶液中:c(H+)>c(OH-)+c(NH3•H2O) |
17.下列有关说法正确的是( )
| A. | 白铁(镀锌铁皮)镀层破损后铁仍不易腐蚀 | |
| B. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)能自发进行,则该反应的△H>0 | |
| C. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) | |
| D. | 合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 |
14.某种碳酸饮料中主要含柠檬酸、碳酸、白砂糖、苯甲酸钠等成分,常温下测得其pH约为3.5,下列说法不正确的是( )
| A. | 常温下,该碳酸饮料中KW的值大于纯水中KW的值 | |
| B. | 该碳酸饮料中水的电离受到抑制 | |
| C. | 柠檬酸的电离会抑制碳酸的电离 | |
| D. | 打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度 |
1.实验室用NaOH固体和蒸馏水准确配置一定物质的量浓度的NaOH溶液,以下仪器不需要用到的是( )
| A. | 烧瓶 | B. | 烧杯 | C. | 容量瓶 | D. | 玻璃棒 |
18.下列说法正确的是( )
| A. | 碱金属的单质中,锂的还原性最强 | |
| B. | 第IA族元素比第IIA族元素的金属性强 | |
| C. | 同周期中,原子半径随原子序数的增大而减小(稀有气体除外) | |
| D. | 随着核电荷数的递增,第三周期元素的氧化物对应的水化物的酸性逐渐增强 |
 .
.
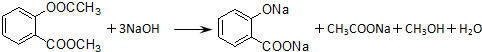 .
.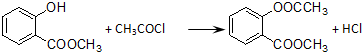 .
.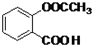 .
.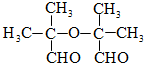 .
.