题目内容
14.某种碳酸饮料中主要含柠檬酸、碳酸、白砂糖、苯甲酸钠等成分,常温下测得其pH约为3.5,下列说法不正确的是( )| A. | 常温下,该碳酸饮料中KW的值大于纯水中KW的值 | |
| B. | 该碳酸饮料中水的电离受到抑制 | |
| C. | 柠檬酸的电离会抑制碳酸的电离 | |
| D. | 打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度 |
分析 碳酸饮料中存在柠檬酸、碳酸、水的电离平衡以及二氧化碳的溶解平衡,结合离子浓度对平衡移动的意向判断电离程度,水的离子积只受温度的影响,以此解答该题.
解答 解:A.温度不变,水的离子积常数不变,所以两种溶液中水的离子积常数相等,故A错误;
B.水电离出氢离子和氢氧根离子,碳酸电离出的氢离子抑制水电离,故B正确;
C.柠檬酸能电离出氢离子,导致溶液中氢离子浓度增大,碳酸也电离出氢离子,所以抑制碳酸电离,故C正确;
D.气体的溶解度随着压强的增大而增大,所以打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度,故D正确;
故选A.
点评 本题考查了弱电解质的电离、影响气体溶解度的因素、水的离子积常数等知识点,根据弱电解质电离特点、温度与水的离子积常数的关系及压强对气体溶解度的关系即可解答,易错选项是A,注意水的离子积常数与溶液的酸碱性无关,为易错点.

练习册系列答案
相关题目
5.化学与生活、环境密切相关,下列说法正确的是( )
| A. | 氢氧化钠和氢氧化铝都可治疗胃酸过多 | |
| B. | 葡萄酒中常含有一定量的S02用来防氧化和杀菌 | |
| C. | 酱油中含有三价铁可补充人体缺乏的铁元素 | |
| D. | 石油分馏的目的是为了获得乙烯、丙烯和丁二烯 |
2.如图所示,常温时将一滴管液体Y一次性全部挤到充满O2的锥形瓶内(装置气密性良好),若锥形瓶内气体的最大物质的量是amol,久置后其气体的物质的量是bmol,不存在a>b关系的是( )
| X | Y | 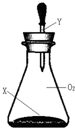 | |
| A | 过量C、Fe碎屑 | 稀HCl | |
| B | 过量Na2CO3粉末 | 稀H2SO4 | |
| C | 过量Fe、Al碎屑 | 浓H2SO4 | |
| D | 过量Cu、CuO粉末 | 浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
9.用NA表示阿伏加德罗常数,下列说法中正确的有( )
| A. | pH=13的NaOH溶液中含有的OH-的数为0.1 NA | |
| B. | Fe在少量Cl2中燃烧生成0.5 mol 产物,转移的电子数为1 NA | |
| C. | 18g D2O中含有的质子数为9NA | |
| D. | 标准状况下,含4 mol HCl的浓盐酸与足量MnO2加热反应可生成22.4 L氯气 |
19.只运用物理方法就能从海水中获得的物质是( )
| A. | I2 | B. | Br2 | C. | Mg | D. | NaCl |
6.如图所示是Zn和Cu形成的原电池,说法正确的是( )


| A. | 铜为负极,锌为正极 | B. | 正极反应为Zn-2e-=Zn2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 原电池的反映本质是氧化还原反应 |
3.下列有关仪器和操作的说法正确的是( )
| A. | 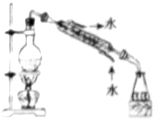 分离Na2CO3溶液和CH3COOC2H5 | B. |  实验室制取少量氨气 | ||
| C. | 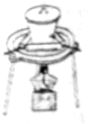 高温煅烧石灰石 | D. | 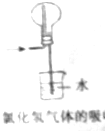 实验室吸收HCl气体 |
4.某有机物的结构简式如图所示,下列说法正确的是( )


| A. | 可使溴的四氯化碳溶液或酸性KMnO4溶液褪色 | |
| B. | 含有两种官能团 | |
| C. | 1mol该有机物与足量钠反应可得到0.5molH2 | |
| D. | 可以发生取代反应和加成反应,但不能发生聚合反应 |
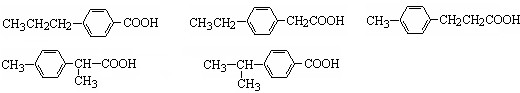 中任意两种.
中任意两种.

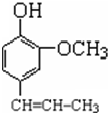 +CH3CH2Cl
+CH3CH2Cl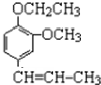 +HCl;
+HCl;