题目内容
【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。请回答下列问题:
(1)一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行合成氨反应。
①下列描述能说明该可逆反应达到化学平衡状态的有__。
A.容器内气体的密度不变
B.c(N2):c(H2):c(NH3)=1:3:2
C.容器内的压强不变
D.相同时间内有3molH-H键断裂,有6molN-H键形成
E.3v正(H2)=2v逆(NH3)
F.容器内气体的平均相对分子质量不变
②恒温恒压条件下,为提高合成氨反应中N2和H2的利用率,可采用的方法__(一种即可)。
(2)一定温度下,2L密闭容器中充入0.40molN2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20s内,v(NO2)=__,该温度下反应的化学平衡常数数值为__。
②升高温度时,气体颜色加深,则正反应是__(填“放热”或“吸热”)反应。
③相同温度下,若开始向该容器中充入0.40mo1NO2,则达到平衡后:c(NO2)__0.15mol/L(填“>”、“=”或“<”)
【答案】C、F 移出NH3 6×10-3mol/(L·s) 1.8 吸热 >
【解析】
(1)①可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量以及由此引起的一系列物理量不变;
(2)①根据表格数据找出平衡时各物质的浓度,计算平衡常数;
③利用等效平衡思想分析。
(1)①A.气体质量和体积不变,容器内气体的密度始终不变,不能说明反应达到平衡状态,故A不选;
B.平衡时各物质的浓度不再改变,但浓度之比不一定等于计量数之比,与反应物投料及转化率有关,故B不选;
C.该反应前后气体系数之和不同,未平衡时气体的物质的量会发生变化,而容器恒容,所以容器内压强会变,容器内的压强不变说明反应达到平衡状态,故C选;
D.相同时间内有3molH-H键断裂,有6mol N-H键形成,二者描述的都是正反应速率,只要反应进行,该关系就存在,故D不选;
E.速率之比等于化学方程式计量数之比,为正反应速率之比,2v正(H2)=3v逆(NH3)能说明反应达到平衡状态,但3v正(H2)=2v逆(NH3)不能证明反应达到平衡状态,故E不选;
F.反应前后气体质量不变,气体物质的量变化,所以未平衡时容器内气体的平均相对分子质量会变,不变时说明反应达到平衡状态,故F选;
综上所述选C、F;
②恒温恒压条件下,可以及时移走生成的NH3使平衡正向移动,增大反应物的利用率;
(2)①20s内,v(NO2)=![]() = 6×10-3mol/(L·s);
= 6×10-3mol/(L·s);
根据表格数据可知80s时反应已经达到平衡,此时△c(NO2)=0.30mol/L,根据方程式可知△c(N2O4)=0.15mol/L,初始投料0.40molN2O4,容器体积为2L,所以平衡时c(N2O4)=0.05mol/L,则该温度下平衡常数为![]() =1.8;
=1.8;
②升高温度颜色加深,说明向生成NO2的方向移动,即正向移动,所以正反应为吸热反应;
③若开始向该容器中充入0.40mo1NO2,极限转化相当于充入0.20molN2O4,假如二者达到等效平衡,则c(NO2)=0.15mol/L,但实际上由于气体的物质的量减少,容器内压强降低,平衡会在等效平衡的基础上向生成NO2的方向移动,所以c(NO2)>0.15mol/L。

 阅读快车系列答案
阅读快车系列答案【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_______________________________________。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为_____________________。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=_______________mol·L-1(填精确计算结果)。
(5) 将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为__________________________。
【题目】二氧化钛是目前使用最广泛的白色颜料。工业上,以钛铁矿(主要成分为钛酸亚铁[FeTiO3],含有少量SiO2杂质)为原料制备二氧化钛的过程如下图所示。
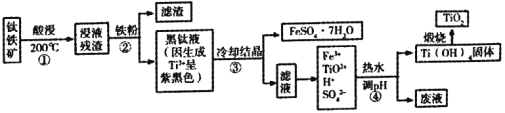
已知:①超过70℃TiO2+易水解;低于0℃ FeSO4·7H2O大量结晶。
②钛的化合价主要有+4价和+3价,其中Ti3+(紫黑色)还原性比Fe2+强
③有关氢氧化物开始沉淀的pH如下:
氢氧化物 | Ti(OH)4 | Ti(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀时的pH | 0.5 | 3.0 | 1.5 | 7.6 |
根据相关信息回答下列问题;
(1)酸浸过程选用的酸是__________。
(2)步骤①中生成Fe2+和TiO2+的化学反应方程式为__________。
(3)以下相关描述正确的是__________。
A 步骤②中加入铁粉,在防止Fe2+转化成Fe3+的同时也将部分TiO2+氧化成了Ti3+
B 步骤③中的降温结晶过程可以选择冰水混合物
C ③中发生了反应Fe3++ Ti3++H2O== Fe2++ TiO2++2H+
D 废液成分中有硫酸,可以循环利用
(4)步④中生成Ti(OH)4的离子方程式为__________,选择的pH范围是__________。
(5)证明步骤④中Ti (OH)4固体已经洗涤干净的方法是__________。
(6)钛酸锂(Li4Ti5O12)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池总反应式为:LiXO2(s)+Li4Ti5O12(s)=Li1-aXO2+Li4+aTi5O12(s),则其负极反应式为__________。