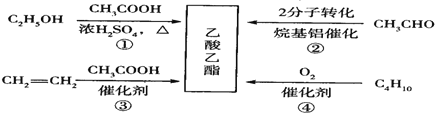
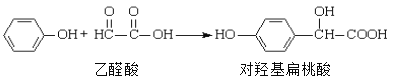
题目内容
【题目】某混合气体由两种气态烃组成。2.24L该混合气体完全燃烧后,得到4.48L二氧化碳(气体均已折算为标准状况)和3.6g水。则这两种气体可能是( )
A.CH4和C3H4B.CH4和C3H8
C.C2H6和C3H4D.C2H4和C2H6
【答案】A
【解析】
2.24L该混合烃的物质的量是![]() ;4.48L二氧化碳的物质的量是
;4.48L二氧化碳的物质的量是![]() ;3.6g水的物质的量是
;3.6g水的物质的量是![]() ;根据烃燃烧通式
;根据烃燃烧通式![]() ,可知平均分子式是C2H4;
,可知平均分子式是C2H4;
A. CH4和C3H4按照1:1混合,平均分子式为C2H4,故A符合;
B. CH4和C3H8混合,平均H原子数目介于4~8之间,不可能为4,故B不符合;
C.C2H6和C3H4混合,平均C原子数目介于2~3之间,不可能为2,平均H原子数目介于4~8之间,不可能为4,故C不符合;
D.C2H4和C2H6混合,以任意比混合,平均C原子数目都是2,平均H原子数目介于4~6之间,不可能为4,故D不符合;
故选A。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。请回答下列问题:
(1)一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行合成氨反应。
①下列描述能说明该可逆反应达到化学平衡状态的有__。
A.容器内气体的密度不变
B.c(N2):c(H2):c(NH3)=1:3:2
C.容器内的压强不变
D.相同时间内有3molH-H键断裂,有6molN-H键形成
E.3v正(H2)=2v逆(NH3)
F.容器内气体的平均相对分子质量不变
②恒温恒压条件下,为提高合成氨反应中N2和H2的利用率,可采用的方法__(一种即可)。
(2)一定温度下,2L密闭容器中充入0.40molN2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20s内,v(NO2)=__,该温度下反应的化学平衡常数数值为__。
②升高温度时,气体颜色加深,则正反应是__(填“放热”或“吸热”)反应。
③相同温度下,若开始向该容器中充入0.40mo1NO2,则达到平衡后:c(NO2)__0.15mol/L(填“>”、“=”或“<”)