题目内容
将一定量的氯气通入30mL浓度为10.00 mol·L-1的NaOH浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
| A.与NaOH反应的氯气一定为0.3mol |
| B.n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为n mol ,则0.15<n<0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
C
解析试题分析:因为反应后的溶液为NaCl、NaClO、NaClO3共存体系。在这几种物质中n(Na):n(Cl)=" 1:1." n(NaOH)="0.03L×10.00" mol/L=0.3mol。所以与NaOH反应的氯气一定为0.3×1/2=0.15mol错误。B.假设n(Na+)=7mol,若n(Na+):n(Cl-)为7:3,则n(Cl-)=3mol。在反应的过程中电子转移3mol,而NaClO、NaClO3的物质的量的和为4,失去的电子的物质的量最小值为4,不符合电子守恒。错误。C.若反应中转移的电子为n mol ,则n(Cl-)=nmol;n(NaClO)+n(NaClO3)=(0.3-n)mol。若氧化产物全为NaClO ,根据电子守恒可得反应方程式:Cl2+2NaOH=NaCl+NaClO+H2O可知:n(NaCl)=n(NaClO)=0.3mol÷2=0.15mol;若氧化产物全为NaClO3,根据电子守恒可得反应方程式:3Cl2+6NaOH=5NaCl+NaClO3+H2O可知:n(NaCl)= 5n(NaClO)=0.3mol÷5/6=0.25mol;而事实上两种氧化产物都存在。因此存在关系:0.15<n<0.25。正确。D.若物质的关系为 n(NaCl):n(NaClO):n(NaClO3),则得到的电子的物质的量为1×11=11;而失去的电子的物质的量为1×2+1×5=7,得失电子数目不等,错误。
考点:考查氯气与NaOH溶液反应原理及电子转移的知识。

 阅读快车系列答案
阅读快车系列答案化学与科学、技术、社会、环境密切相关。下列说法正确的是
| A.盐酸与氢氧化钠的反应可自发进行,因此可用作原电池反应原理 |
| B.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| C.铁粉、硅胶是食品包装中常用的干燥剂 |
| D.铝表面可生成一层致密的氧化物薄膜,因此可用铝容器盛装稀硫酸 |
下列陈述Ⅰ和Ⅱ正确并且有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
| B | SO2有氧化性 | SO2尾气可用NaOH溶液吸收 |
| C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| D | NH3和HCl在水中溶解度很大 | 充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升 |
A~D是含同一元素的四种物质,它们相互之间有如图所示的转化关系,其中A是单质,D
是氢氧化物,则A可能是( )
①Al ②Mg ③Fe ④Na
| A.①③ | B.①②③ | C.①② | D.②③④ |
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
| A.原混合物中铜和铁各0.15 mol | B.稀硝酸的物质的量浓度为1 mol·L-1 |
| C.第一次剩余9.6 g金属为铜和铁 | D.再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO |
下列说法正确的是
| A.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 |
| B.饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释 |
| C.在c(H+)/c(OH-)= l012 溶液中 N a+、I-、NO3-、SO42-不能大量共存 |
| D.在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极 |
下表中各组物质之间不能通过一步反应实现右图转化的是
| | 甲 | 乙 | 丙 |
| A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
| B | SiO2 | H2SiO3 | Na2SiO3 |
| C | Cl2 | HCl | CuCl2 |
| D | AlCl3 | Al(OH)3 | Al2O3 |

工业上焙烧明矾[ (SO4)2·12H2O]的化学方程式为:4Al(SO4)2·12H2O+3S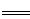 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
| A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4 |
| B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-) |
| C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M=" 474" g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t |
D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是Al+3NiO(OH)+NaOH  NaAlO2+3Ni(OH)2 NaAlO2+3Ni(OH)2 |
下列关于100mL 0.1mol/L Na2CO3溶液叙述中不正确的是
| A.100mL 0.1mol/L Na2CO3溶液中含有CO32-的数目小于0.01NA |
| B.热的碳酸钠溶液比冷的碳酸钠溶液洗涤餐具效果好 |
| C.用碳酸钠除去锅炉中的水垢(主要成分是CaSO4),使之转化为疏松、易溶于酸的碳酸钙。 |
| D.100mL 0.1mol/L Na2CO3溶液中:n(CO32-)+n(HCO3-)+n(OH?)=0.01mol |