题目内容
9.如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的( )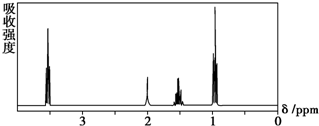
| A. | CH3CH2CH2CH3 | B. | (CH3)2CHCH3 | C. | CH3CH2CH2OH | D. | CH3CH2COOH |
分析 分子中含化学环境不同的H原子,则核磁共振氢谱就有几种不同的信号峰,且峰面积之比等于氢原子数目之比,以此来解答.
解答 解:由图可知,核磁共振氢谱中给出4个吸收峰峰,说明该分子中的有4种H原子.
A.CH3CH2CH2CH3中有2种H原子,核磁共振氢谱中有2个吸收峰,故A不符合;
B.(CH3)2CHCH3中有2种H原子,核磁共振氢谱中有2个吸收峰,故B不符合;
C.CH3CH2CH2OH中有4种H原子,核磁共振氢谱中有4个吸收峰,故C符合;
D.CH3CH2COOH中有3种H原子,核磁共振氢谱中有3个吸收峰,故D不符合;
故选C.
点评 本题主要考查有机物结构确定、核磁共振氢谱,题目难度不大,等效氢的判断是解题的关键.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
7.下列离子方程式中正确的是( )
| A. | 向NaHSO4溶液中滴加Ba(OH)2至SO42-沉淀完全:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 碳酸钠溶液与醋酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | 氢氧化亚铁与硝酸混合:Fe(OH)2+2H+=Fe2++2H2O | |
| D. | 将1~2mL氯化铁饱和溶液加到20mL沸水中:Fe3++3H2O?Fe(OH)3(胶体)+3H+ |
5.要除去下表中各粉末状混合物中的杂质,括号内为杂质,填写所用试剂和操作操作,如不需要则用/表示.
| 样品 | 所加试剂 | 主要操作 | 化学方程式 |
| SiO2(CaCO3) | |||
| CaCO3(SiO2) | |||
| Fe(Si) | |||
| SiO2(H2SiO3) |
14.下列说法正确的是( )
| A. | SiH4比CH4稳定 | |
| B. | O2-半径比F-的小 | |
| C. | Na 和Cs 属于第IA 族元素,Cs 失电子能力比Na的强 | |
| D. | P 和As属于第VA 族元素,H3PO4酸性比H3AsO4的弱 |
1.下列化学反应的方程式书写正确的是( )
| A. | 高温下加热硝酸铵固体:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HNO3↑ | |
| B. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 工业制粗硅:C+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+Si |
18.影响化学反应速率的因素很多,某化学兴趣小组进行化学反应速率影响因素的探究实验:KI在经酸化的溶液中被空气氧化的反应式为:4H++4I-+O2═2I2+2H2O.该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率.已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深.
实验小组拟用0.8mol•L-1KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如下表:
(1)为确保A组实验在39℃下进行,应采用的控温操作方法是将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度.
(2)A-C三组实验时,都加入了5mL水,其目的是为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变(凡表达出“控制变量”、“对比实验”意思的各种合理答案都得分).
(3)B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
(4)请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
(5)按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论设计酸体积<10mL时,t预测值要小于同温对比值;设计酸体积>10mL时,t预测值要大于同温对比值,结论:酸度越大反应速率越快.
实验小组拟用0.8mol•L-1KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如下表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
(2)A-C三组实验时,都加入了5mL水,其目的是为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变(凡表达出“控制变量”、“对比实验”意思的各种合理答案都得分).
(3)B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
(4)请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
(5)按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论设计酸体积<10mL时,t预测值要小于同温对比值;设计酸体积>10mL时,t预测值要大于同温对比值,结论:酸度越大反应速率越快.
 ,C
,C .
. .
.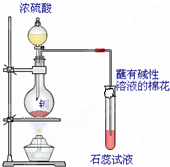 某研究学习小组用如图装置进行铜与浓硫酸反应的实验研究.
某研究学习小组用如图装置进行铜与浓硫酸反应的实验研究.