题目内容
2.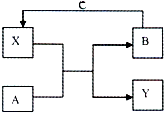 A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )
A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )| A. | 若X是光导纤维的主要成分,工业上常利用反应I制备B,Y的化学式为CO | |
| B. | 若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为Fe3O4+8H++2I-=3Fe 2++I2+4H2O | |
| C. | 若组成A的元素在短周期中原子半径最大(稀有气体除外),以Y为电解质溶液,气体B为燃料,C为氧化剂可构成燃料电池,工作一段时间后,Y溶液的pH增大 | |
| D. | 若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应X检验氯气管道是否漏气,Y的电子式为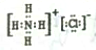 |
分析 A.若X是光导纤维的主要成分,则X为SiO2,X+A→Y+B为置换反应,C和SiO2在高温下发生置换反应生成Si;
B.若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质,为Fe3O4,该反应是铝热反应,则A是Al,B是Fe,Y是Al2O3,铁离子具有氧化性,能氧化碘离子生成亚铁离子同时生成碘单质;
C.若组成A的元素在短周期中原子半径最大(稀有气体除外),为Na,Na和水发生置换反应生成NaOH和氢气,氢气、氧气和NaOH溶液构成原电池,放电时电池反应式为2H2+O2=2H2O,放电过程中生成水,氢氧根离子不参加反应,导致溶液中c(OH-)降低;
D.若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应X检验氯气管道是否漏气,氨气可以检验氯气管道是否漏气,则X为NH3、A是Cl2、B是N2、Y是NH4Cl、C是H2,氯化铵是离子晶体,铵根离子和氯离子之间存在离子键、铵根离子中N-H原子之间存在共价键.
解答 解:A.若X是光导纤维的主要成分,则X为SiO2,X+A→Y+B为置换反应,C和SiO2在高温下发生置换反应生成Si,同时生成CO,所以Y为CO,故A正确;
B.若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质,为Fe3O4,该反应是铝热反应,则A是Al,B是Fe,Y是Al2O3,铁离子具有氧化性,能氧化碘离子生成亚铁离子同时生成碘单质,离子方程式为Fe3O4+8H++2I-=3Fe 2++I2+4H2O,故B正确;
C.若组成A的元素在短周期中原子半径最大(稀有气体除外),为Na,Na和水发生置换反应生成NaOH和氢气,氢气、氧气和NaOH溶液构成原电池,放电时电池反应式为2H2+O2=2H2O,放电过程中生成水,氢氧根离子不参加反应,导致溶液中c(OH-)降低,所以溶液的pH降低,故C错误;
D.若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应X检验氯气管道是否漏气,氨气可以检验氯气管道是否漏气,则X为NH3、A是Cl2、B是N2、Y是NH4Cl、C是H2,氯化铵是离子晶体,铵根离子和氯离子之间存在离子键、铵根离子中N-H原子之间存在共价键,氯化铵的电子式为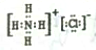 ,
,
故选C.
点评 本题考查无机推断,涉及置换反应、原电池原理、元素化合物等知识,熟练掌握常见置换反应,注意C和二氧化硅反应时生成CO而不是二氧化碳,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | 异戊二烯(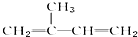 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 | |
| D. | 邻羟基苯甲酸与NaHCO3溶液反应 |
| A. | 所有元素均为主族元素 | |
| B. | 金属元素的有7种 | |
| C. | 13号元素的最高价氧化物既能溶于强酸又能溶于强碱 | |
| D. | 8号元素的氢化物中所有原子都满足最外层8电子结构 |
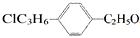 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )| A. | 25种 | B. | 20种 | C. | 16种 | D. | 14种 |
| A. | 0.1mol/L的HNO3溶液中由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a<7,则pH一定为a | |
| C. | 在小苏打水溶液中存在的电离平衡有:NaHCO3?Na++HCO3-,HCO3-?CO32-+H+,H2O?H++OH- | |
| D. | NH3•H2O和NH4Cl混合液pH=7,则c(NH4+)=c(NH3•H2O)>c(H十)=c(OH-) |