题目内容
1.岩石风化后,地下水溶解其中可溶 部分形成了矿泉水.风化作用是指矿物与水和CO2同时作用的过程.例如,正长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式为:2KAlSi3O8+2H2CO3+5H2O═2K++2HCO3-+4H2SiO3+Al2Si2O5(OH)4.(1)将上述复杂硅酸盐改写成氧化物的形式:①KAlSi3O8:K2O•Al2O3•6SiO2.②Al2Si2O5(OH)4:A2O3•2SiO2•2H2O.
(2)这个反应能够发生的原因是碳酸酸性比硅酸强,由强酸可制得弱酸.
分析 (1)根据化学式改写成相应的氧化物的形式,按照活泼金属氧化物•较活泼金属氧化物•SiO2•H2O的顺序来书写,并要遵守原子守恒来分析解答.
(2)化学反应多数遵循强酸制备弱酸的原则.
解答 解:(1)①钾的氧化物为K2O,铝的氧化物为Al2O3,硅的氧化物为SiO2,则根据活泼金属氧化物.较活泼金属氧化物.SiO2.H2O的顺序可知,KAlSi3O8可改写为K2O•Al2O3•6SiO2,故答案为:K2O•Al2O3•6SiO2;
②铝的氧化物为Al2O3,硅的氧化物为SiO2,氢的氧化物为H2O,则根据活泼金属氧化物.较活泼金属氧化物.SiO2.H2O的顺序可知,[Al2Si2O5(OH)4]可改成Al2O3.2SiO2.2H2O,
故答案为:Al2O3.2SiO2.2H2O.
(2)碳酸可生成原硅酸,说明碳酸的酸性比原硅酸的强,故此反应发生的原因是碳酸酸性比硅酸强,由强酸可制得弱酸,故答案为:碳酸酸性比硅酸强,由强酸可制得弱酸.
点评 本题考查含硅矿物及材料的应用,注重将复杂化合物写出氧化物的形式的考查,注意要知道非金属元素氧化物的化学式的书写和先后顺序,还有遵循原子守恒定律,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.常温下,下列说法中,正确的是( )
| A. | 0.1mol/L的HNO3溶液中由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a<7,则pH一定为a | |
| C. | 在小苏打水溶液中存在的电离平衡有:NaHCO3?Na++HCO3-,HCO3-?CO32-+H+,H2O?H++OH- | |
| D. | NH3•H2O和NH4Cl混合液pH=7,则c(NH4+)=c(NH3•H2O)>c(H十)=c(OH-) |
16.下列物质与酸的反应中,只表现出酸性作用的是( )
| A. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | B. | C+4HNO3(浓)═CO2↑+4NO2↑+2H2O | ||
| C. | 3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O | D. | CuO+2HNO3(稀)═Cu(NO3)2+H2O |
6.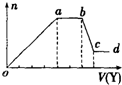 某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
(1)若Y是盐酸,则X中一定含有的离子是CO32-、SiO32-、AlO2-、Na+,oa段发生反应的离子方程式SiO32-+2H+═H2SiO3↓、AlO2-+H++H2O═Al(OH)3↓,(指来源于X溶液的,下同) ab段发生反应的离子方程式CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,bc段发生反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
(2)若Y是NaOH溶液,则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,则oa段转化为沉淀的离子是Al3+、Mg2+,ab段反应的离子方程式为NH4++OH-═MH3•H2O.bc段反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
 某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.| 阴离子 | CO32-、Si32-、AlO2-、Cl- |
| 氧离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(2)若Y是NaOH溶液,则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,则oa段转化为沉淀的离子是Al3+、Mg2+,ab段反应的离子方程式为NH4++OH-═MH3•H2O.bc段反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
13.在2L密闭容器中进行反应:mX(g)+nY(g)?pZ(g)+qQ(g),式中m、n、p、q为物质系数.在2s内,用X表示平均速率为0.3m/p mol/(L•s),则在2s内,Q物质增加的物质的量为( )
| A. | 1.2q/p mol | B. | 1.2m/p mol | C. | 0.6q/p mol | D. | 0.3q/p mol |
10.气体摩尔体积在同温、同压下相等的本质原因是在同温、同压下( )
| A. | 气体体积的大小只随分子数变化 | |
| B. | 不同气体分子的大小几乎相等 | |
| C. | 不同气体分子间的平均距离几乎相等 | |
| D. | 气体分子的平均距离与分子本身大小成正比 |
11.能鉴别CO2和SO2的试剂是( )
| A. | 品红溶液 | B. | 澄清石灰水 | ||
| C. | 紫色石蕊试液 | D. | 氯化钡溶液和氯水 |