题目内容
14.在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:若用这两种方法制得的铜质量相等,则下列有关说法符合实际情况的是( )(1)Fe$\stackrel{H_{2}SO_{4}}{→}$H2$\stackrel{CuO}{→}$Cu
(2)CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu.
| A. | 消耗氧化铜的质量不同 | B. | 消耗铁的质量相同 | ||
| C. | 消耗硫酸的质量相同 | D. | 生成硫酸亚铁的质量不同 |
分析 两种方法制得的铜质量相等,由质量守恒可知消耗的氧化铜质量相等,因生成的氢气不能全部反应,则消耗的铁、硫酸的质量不同,以此解答该题.
解答 解:用H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些,自然H2SO4和Fe的量也要多一些,则消耗的铁、硫酸以及生成的硫酸亚铁的质量不同;Cu元素都能形成单质Cu,而都来自CuO,没有损失,所以①②氧化铜质量相同,只有D正确.
故选D.
点评 本题考查实验方案的评价,为高频考点,侧重于学生的分析能力的考查,注意把握实验的原理的比较,答题时注意氢气不能全部参加反应的特点,难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
7.组成结构可用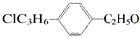 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )
 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )| A. | 25种 | B. | 20种 | C. | 16种 | D. | 14种 |
5.普通干电池两极材料是锌和石墨棒,两极间为MnO2、NH4Cl、ZnCl2糊状物,下列说法错误的是( )
| A. | 干电池中锌作负极,石墨棒作正极 | |
| B. | 负极发生还原反应:Zn-2e-═Zn2+ | |
| C. | MnO2的作用是把正极附近生成的氢气氧化成水,避免氢气泡出现 | |
| D. | 干电池工作时,由化学能转变为电能 |
2.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是( )
| 酸 | 电离平衡常数 |
| 醋酸 | Ki=1.75×10-5 |
| 次氯酸 | Ki=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
| A. | 将0.1 mol•L-1的醋酸加水不断稀释,c(OH-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 |
9.常温下,下列说法中,正确的是( )
| A. | 0.1mol/L的HNO3溶液中由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a<7,则pH一定为a | |
| C. | 在小苏打水溶液中存在的电离平衡有:NaHCO3?Na++HCO3-,HCO3-?CO32-+H+,H2O?H++OH- | |
| D. | NH3•H2O和NH4Cl混合液pH=7,则c(NH4+)=c(NH3•H2O)>c(H十)=c(OH-) |
19.下列物质属于纯净物的是( )
| A. | 高锰酸钾完全分解后的残留物 | B. | 洁净的食盐水 | ||
| C. | 冰、水混合物 | D. | 含氮30%的硝酸铵(NH4NO3) |
6.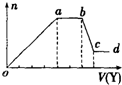 某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
(1)若Y是盐酸,则X中一定含有的离子是CO32-、SiO32-、AlO2-、Na+,oa段发生反应的离子方程式SiO32-+2H+═H2SiO3↓、AlO2-+H++H2O═Al(OH)3↓,(指来源于X溶液的,下同) ab段发生反应的离子方程式CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,bc段发生反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
(2)若Y是NaOH溶液,则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,则oa段转化为沉淀的离子是Al3+、Mg2+,ab段反应的离子方程式为NH4++OH-═MH3•H2O.bc段反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
 某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.| 阴离子 | CO32-、Si32-、AlO2-、Cl- |
| 氧离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(2)若Y是NaOH溶液,则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,则oa段转化为沉淀的离子是Al3+、Mg2+,ab段反应的离子方程式为NH4++OH-═MH3•H2O.bc段反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
3.N2中混有少量CO2气体和水蒸气,除去的正确操作是( )
| A. | 通过无水氯化钙的干燥管 | |
| B. | 通过浓硫酸的洗气瓶 | |
| C. | 先通过氢氧化钠溶液的洗气瓶,再通过浓硫酸的洗气瓶 | |
| D. | 先通过浓硫酸的洗气瓶,再通过氢氧化钠溶液的洗气瓶 |
4.给下列溶液中通入CO2气体,不可能产生沉淀的是( )
| A. | 氯化钙和硝酸钡的混合液 | B. | 稀的水玻璃 | ||
| C. | 偏铝酸钠溶液 | D. | 碳酸钠饱和溶液 |