题目内容
18.浓硫酸与铜加热时反应,生成二氧化硫的体积为2.24L(标准状况).试计算(1)反应后生成硫酸铜的物质的量
(2)若将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?
分析 发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,结合反应及c=$\frac{n}{V}$计算.
解答 解:(1)n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,由Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知,n(CuSO4)=n(SO2)=0.1mol,
答:反应后生成硫酸铜的物质的量为0.1mol;
(2)生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是$\frac{0.1mol}{0.5L}$=0.2mol/L,
答:该溶液中溶质的物质的量浓度是0.2mol/L.
点评 本题考查化学反应方程式的计算,为基础性习题,把握发生的反应及反应中物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
9.常温下,下列说法中,正确的是( )
| A. | 0.1mol/L的HNO3溶液中由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a<7,则pH一定为a | |
| C. | 在小苏打水溶液中存在的电离平衡有:NaHCO3?Na++HCO3-,HCO3-?CO32-+H+,H2O?H++OH- | |
| D. | NH3•H2O和NH4Cl混合液pH=7,则c(NH4+)=c(NH3•H2O)>c(H十)=c(OH-) |
6.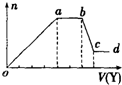 某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
(1)若Y是盐酸,则X中一定含有的离子是CO32-、SiO32-、AlO2-、Na+,oa段发生反应的离子方程式SiO32-+2H+═H2SiO3↓、AlO2-+H++H2O═Al(OH)3↓,(指来源于X溶液的,下同) ab段发生反应的离子方程式CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,bc段发生反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
(2)若Y是NaOH溶液,则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,则oa段转化为沉淀的离子是Al3+、Mg2+,ab段反应的离子方程式为NH4++OH-═MH3•H2O.bc段反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
 某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.| 阴离子 | CO32-、Si32-、AlO2-、Cl- |
| 氧离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(2)若Y是NaOH溶液,则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,则oa段转化为沉淀的离子是Al3+、Mg2+,ab段反应的离子方程式为NH4++OH-═MH3•H2O.bc段反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
13.在2L密闭容器中进行反应:mX(g)+nY(g)?pZ(g)+qQ(g),式中m、n、p、q为物质系数.在2s内,用X表示平均速率为0.3m/p mol/(L•s),则在2s内,Q物质增加的物质的量为( )
| A. | 1.2q/p mol | B. | 1.2m/p mol | C. | 0.6q/p mol | D. | 0.3q/p mol |
3.N2中混有少量CO2气体和水蒸气,除去的正确操作是( )
| A. | 通过无水氯化钙的干燥管 | |
| B. | 通过浓硫酸的洗气瓶 | |
| C. | 先通过氢氧化钠溶液的洗气瓶,再通过浓硫酸的洗气瓶 | |
| D. | 先通过浓硫酸的洗气瓶,再通过氢氧化钠溶液的洗气瓶 |
10.气体摩尔体积在同温、同压下相等的本质原因是在同温、同压下( )
| A. | 气体体积的大小只随分子数变化 | |
| B. | 不同气体分子的大小几乎相等 | |
| C. | 不同气体分子间的平均距离几乎相等 | |
| D. | 气体分子的平均距离与分子本身大小成正比 |
7.下列有关实验操作的叙述中,错误的是( )
| A. | 实验室用排水集气法收集氧气完毕,把导管从水中取出,然后移去酒精灯 | |
| B. | 氢气还原氧化铜的实验结束,先移去酒精灯,待试管冷却后再停止通氢气 | |
| C. | 倾倒液体进行过滤时,应使液体沿着玻璃棒流下,且液面低于滤纸边缘 | |
| D. | 因NaOH有腐蚀性,可在天平两托盘上放同样的滤纸后再放NaOH,然后进行称量 |
8.在标准状况下,H2和Cl2各nL,经混合光照反应后,所得气体恰好使bmolNaOH完全转化为盐,n与b的关系可能是( )
| A. | b=$\frac{n}{22.4}$ | B. | b=$\frac{22.4}{n}$ | C. | b=$\frac{n}{11.2}$ | D. | b=11.2n |