题目内容
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氢化法制备高铁酸钠,生产过程如下:

(1)高铁酸钠中铁元素的化合价为____________,次氯酸钠的电子式是__________________。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是__________________。
(3)步骤①反应的离子方程式是_________________________________。
(4)Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_________。(计算结果保留两位小数)
工业废水中常含有一定量的Cr2O![]() 易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O![]() 转化为Cr3+,再将Cr3+转化为沉淀。
转化为Cr3+,再将Cr3+转化为沉淀。
(5)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理_____________________________________________。
(6)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为_________。
(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。写出Cr(OH)3的酸式电离方程式______________。
(8)Cr3+在强碱溶液中可被双氧水氧化为CrO![]() ,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO
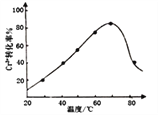
,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO![]() +8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
+8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
【答案】 +6 ![]()
![]()
![]() 0.64
0.64 ![]() 6
6 ![]() 或
或![]()
![]() 双氧水在较高温度下发生分解,浓度降低
双氧水在较高温度下发生分解,浓度降低
【解析】(1)钠元素的化合价为![]() 价,氧元素的化合价为
价,氧元素的化合价为![]() 价,根据化合价代数和为0,可得铁元素的化合价为
价,根据化合价代数和为0,可得铁元素的化合价为![]() 价;次氯酸钠属于离子化合物,由钠离子和次氯酸根离子组成,其电子式为
价;次氯酸钠属于离子化合物,由钠离子和次氯酸根离子组成,其电子式为![]() ;正确答案:+6 ;
;正确答案:+6 ;![]() 。
。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是 ;正确答案:
;正确答案: 。
。
(3)硫酸亚铁被双氧水氧化为硫酸铁,反应的离子方程式是:![]() ;正确答案:
;正确答案:![]() 。
。
(4)根据电子得失守恒规律可知:1molNa2FeO4中铁元素由+6价降低到+3价,得到3mol电子;1mol氯气由0价降低到-1价,得到2 mol电子;所以:设两种消毒剂的质量为1g,所以1gNa2FeO4得电子的量为1/166×3=0.018mol; 1g氯气得电子的量为1/71×2=0.028mol,所以Na2FeO4的消毒效率约是氯气的0.018/0.028=0.64 ;正确答案:0.64 。
(5)根据题给信息可知:SO2做还原剂,能够把Cr2O![]() 还原为Cr3+;离子方程式为:
还原为Cr3+;离子方程式为:![]() ;正确答案:
;正确答案:![]() 。
。
(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,Cr(OH)3的酸式电离方程式:![]() 或
或![]() ;正确答案:
;正确答案:![]() 或
或![]() 。
。
(6)根据K
(8)根据图像可知:![]() ,双氧水在较高温度下发生分解,浓度降低;正确答案:
,双氧水在较高温度下发生分解,浓度降低;正确答案:![]() ,双氧水在较高温度下发生分解,浓度降低。
,双氧水在较高温度下发生分解,浓度降低。

【题目】25 ℃,两种酸的电离常数如下右表。下列说法正确的是
酸 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-6 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
A. H2CO3的电离方程式为H2CO3![]() 2H++CO
2H++CO![]()
B. 酸性强弱顺序为H2SO3>H2CO3>HSO>HCO
C. 0.2 mol/L Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)>c(H+)
)>c(HCO)>c(OH-)>c(H+)
D. 足量SO2气体通入NaHCO3溶液中,反应的离子方程式为SO2+HCO==HSO+CO2