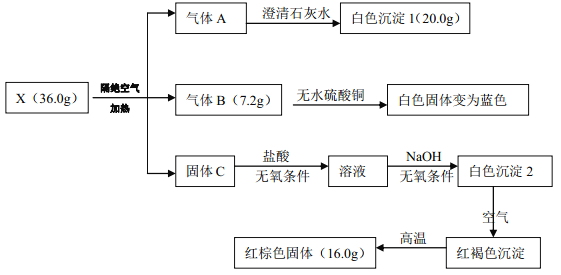
题目内容
【题目】25 ℃时,不同酸性条件下的0.1 mol·L-1 HF溶液中,c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是

A. 随着溶液pH增大,![]() 不断增大
不断增大
B. 由水电离出的c(H+):Q>X=Y
C. HF的电离常数Ka=1.0×10-3.2
D. 0.1 mol/LNaF溶液的pH约为8.2
【答案】D
【解析】根据Ka=c(H+)×c(F-)/c(HF), Ka/c(F-)=![]() ,随着溶液pH增大,酸性减弱,碱性增强,溶液中c(F-)逐渐增大,Ka/c(F-)逐渐减小,
,随着溶液pH增大,酸性减弱,碱性增强,溶液中c(F-)逐渐增大,Ka/c(F-)逐渐减小,![]() 不断减小,A错误;酸溶液抑制水的电离,酸性越强对水电离抑制程度越大,水电离出的c(H+)就越小,从图像可以看出,X 、Q、Y三点对应溶液的pH逐渐增大,酸性减弱,所以由水电离出的c(H+)应逐渐增大,B错误;HF的电离常数Ka=c(H+)×c(F-)/c(HF),当c(F-)= c(HF)时,溶液的pH=10-3.4mol/L,所以HF的电离常数Ka=1.0×10-3.4,C错误;0.1 mol/LNaF溶液水解平衡常数Kh=KW/Ka=1×10-14/1.0×10-3.4=10-10.6, Kh= c(HF)×c(OH-)/c(F-)= c2(OH-)/0.1=10-10.6, c(OH-)=10-5.8mol/L, c(H+)=10-8.2 mol/L, pH约为8.2,D正确;正确选项D。
不断减小,A错误;酸溶液抑制水的电离,酸性越强对水电离抑制程度越大,水电离出的c(H+)就越小,从图像可以看出,X 、Q、Y三点对应溶液的pH逐渐增大,酸性减弱,所以由水电离出的c(H+)应逐渐增大,B错误;HF的电离常数Ka=c(H+)×c(F-)/c(HF),当c(F-)= c(HF)时,溶液的pH=10-3.4mol/L,所以HF的电离常数Ka=1.0×10-3.4,C错误;0.1 mol/LNaF溶液水解平衡常数Kh=KW/Ka=1×10-14/1.0×10-3.4=10-10.6, Kh= c(HF)×c(OH-)/c(F-)= c2(OH-)/0.1=10-10.6, c(OH-)=10-5.8mol/L, c(H+)=10-8.2 mol/L, pH约为8.2,D正确;正确选项D。

【题目】某实验兴趣小组按如图装置实验后,所记录内容合理的是
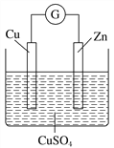
实验记录 | ①Zn片为负极,质量减少,Cu为正极,质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42向Zn极移动,Cu2+向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e===Cu; ⑥电子流动方向:锌极→导线→铜极→电解质溶液→锌极 |
A. ①②④B. ②③④C. ②③④⑤D. ②③④⑤⑥
【题目】下表中对离子方程式的评价合理的是
选项 | 化学反应及其离子方程式 | 评价 |
A | H2SO4溶液与Ba(OH)2溶液反应: H++ SO42-+Ba2++OH | 正确 |
B | 向碳酸镁浊液中加入足量稀盐酸: CO32-+2H+ | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O | 正确 |
D | 向NaOH溶液中通入少量CO2反应:OH+CO2 | 正确 |
A. A B. B C. C D. D