题目内容
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,分别进行下列两项实验:
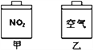
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
已知:N2O4(g)![]() 2NO2(g) △H>0在以上两情况下,甲和乙容器的体积大小,正确的是
2NO2(g) △H>0在以上两情况下,甲和乙容器的体积大小,正确的是
A. (a)甲>乙,(b)甲>乙 B. (a)甲>乙,(b)甲=乙
C. (a)甲<乙,(b)甲>乙 D. (a)甲>乙,(b)甲<乙
【答案】D
【解析】(a)在沸水中,气体体积都受热膨胀,甲中存在平衡N2O4(g)![]() 2NO2(g) △H>0,升高温度,平衡正向移动,使体积进一步增大,所以体积:甲
2NO2(g) △H>0,升高温度,平衡正向移动,使体积进一步增大,所以体积:甲![]() 乙; (b)都加
乙; (b)都加![]() 的砝码,压强增大,气体都缩小,甲中存在平衡N2O4(g)
的砝码,压强增大,气体都缩小,甲中存在平衡N2O4(g)![]() 2NO2(g) △H>0,增大压强,平衡逆向移动,体积减小得更多,所以体积:甲
2NO2(g) △H>0,增大压强,平衡逆向移动,体积减小得更多,所以体积:甲![]() 乙;D正确;正确选项D。
乙;D正确;正确选项D。

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目