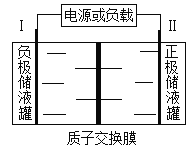
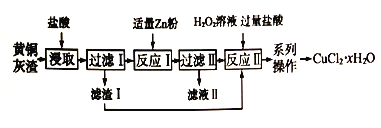
题目内容
【题目】25 ℃,两种酸的电离常数如下右表。下列说法正确的是
酸 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-6 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
A. H2CO3的电离方程式为H2CO3![]() 2H++CO
2H++CO![]()
B. 酸性强弱顺序为H2SO3>H2CO3>HSO>HCO
C. 0.2 mol/L Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)>c(H+)
)>c(HCO)>c(OH-)>c(H+)
D. 足量SO2气体通入NaHCO3溶液中,反应的离子方程式为SO2+HCO==HSO+CO2
【答案】D
【解析】H2CO3属于二元弱酸,分步电离,以第一步为主:H2CO3![]() H++HCO3-,HCO3-
H++HCO3-,HCO3-![]() H++ CO32-,不能一步写出;A错误;由表可以知道
H++ CO32-,不能一步写出;A错误;由表可以知道![]() 的二级电离大于
的二级电离大于![]() 的一级电离,所以酸性强弱顺序:H2SO3 >HSO >H2CO3>HCO;B错误;Na2CO3溶液水解显碱性,水解过程如下:CO32-+H2O
的一级电离,所以酸性强弱顺序:H2SO3 >HSO >H2CO3>HCO;B错误;Na2CO3溶液水解显碱性,水解过程如下:CO32-+H2O![]() HCO3-+OH-, HCO3-+H2O
HCO3-+OH-, HCO3-+H2O![]() H2CO3+ OH-;根据水解规律可知离子浓度大小顺序为:c(Na+)>c(CO
H2CO3+ OH-;根据水解规律可知离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(OH-)>c(HCO)>c(H+),C错误;由表可以知道 H2SO3的酸性大于 H2CO3的酸性,所以反应的主要离子方程式为
)>c(OH-)>c(HCO)>c(H+),C错误;由表可以知道 H2SO3的酸性大于 H2CO3的酸性,所以反应的主要离子方程式为![]() ↑
↑![]() , 或SO2+HCO==HSO+CO2,D正确;正确选项D。
, 或SO2+HCO==HSO+CO2,D正确;正确选项D。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目