题目内容
下图为元素周期表的一部分,根据元素①~⑧在周期表中的位置,按要求回答下列问题。
(1)在元素①~⑧中,金属性最强的元素是_____________(填元素符号),最不容易形成化合物的元素是______________(填元素符号)。
(2)用电子式表示⑦的气态氢化物的形成过程__________________________________。
(3)③、④、⑥中原子半径由大到小的顺序是____________________(填元素符号)。
(4)表中两种元素的原子按1:1组成的常见液态化合物X易被催化分解。某同学取5支大小相同的试管,各加入等物质的量浓度等体积的X溶液,分别进行下列实验,研究外界条件对X分解反应速率的影响,实验记录如下表所示。
①第一组实验目的是:相同条件下,探究________________对该反应速率的影响。
实验2的催化剂A是___________________。
②第二组实验中,实验4的温度t是_________________,发生反应的化学方程式是___________________________________________________________________________。
第二组实验结论是:__________________________________________________。
| 族 周期 | IA | | 0 | |||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | | | | | | ② | ③ | |
| 3 | ④ | ⑤ | | | | ⑥ | ⑦ | ⑧ |
(1)在元素①~⑧中,金属性最强的元素是_____________(填元素符号),最不容易形成化合物的元素是______________(填元素符号)。
(2)用电子式表示⑦的气态氢化物的形成过程__________________________________。
(3)③、④、⑥中原子半径由大到小的顺序是____________________(填元素符号)。
(4)表中两种元素的原子按1:1组成的常见液态化合物X易被催化分解。某同学取5支大小相同的试管,各加入等物质的量浓度等体积的X溶液,分别进行下列实验,研究外界条件对X分解反应速率的影响,实验记录如下表所示。
| | 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | ||||
| 第一组 | 1 | 40 | FeCl3溶液 | 快速产生大量气泡 | 相同条件下,温度升高,化学反应速率加快 |
| 2 | 20 | A | 缓慢产生适量气泡 | ||
| 3 | 5 | FeCl3溶液 | 缓慢产生极少量气泡 | ||
| 第二组 | 4 | t | MnO2 | 快速产生大量气泡 | |
| 5 | 20 | 无 | 缓慢产生极少量气泡 | ||
①第一组实验目的是:相同条件下,探究________________对该反应速率的影响。
实验2的催化剂A是___________________。
②第二组实验中,实验4的温度t是_________________,发生反应的化学方程式是___________________________________________________________________________。
第二组实验结论是:__________________________________________________。
(10分,化学方程式2分,其余每空1分)(1)Na Ar
(2)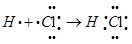 (3)Na>S>F (4)①温度 ②FeCl3溶液 ③20
(3)Na>S>F (4)①温度 ②FeCl3溶液 ③20
④ ⑤在20℃(或相同条件下),MnO2可以加快H2O2分解的反应速率。
⑤在20℃(或相同条件下),MnO2可以加快H2O2分解的反应速率。
(2)
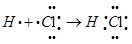 (3)Na>S>F (4)①温度 ②FeCl3溶液 ③20
(3)Na>S>F (4)①温度 ②FeCl3溶液 ③20④
 ⑤在20℃(或相同条件下),MnO2可以加快H2O2分解的反应速率。
⑤在20℃(或相同条件下),MnO2可以加快H2O2分解的反应速率。试题分析:根据元素在周期表中的相对位置,元素①~⑧分别是H、O、F、Na、Mg、S、Cl、Ar。
(1)同周期自左向右金属性逐渐降低,同主族自上而下,金属性逐渐升高,所以在元素①~⑧中,金属性最强的元素是Na。最不容易形成化合物的元素是稀有气体元素Ar。
(2)氯元素的气态氢化物是氯化氢,含有共价键的共价化合物,其形成过程可表示为
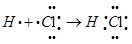 。
。(3)同周期自左向右,原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,所以③、④、⑥中原子半径由大到小的顺序是Na>S>F。
(4)①第一组中不同的是温度,因此实验目的是:相同条件下,探究温度对该反应速率的影响。要探究温度对电反应速率对影响,则其它条件都是相同的,因此A是氯化铁溶液。
②第二组实验中中不同的催化剂,因此是探究催化剂对反应速率影响的,因此实验4的温度t仍然是20℃,反应的化学方程式是2H2O2MnO2 2H2O+O2↑。根据实验现象可知,加入催化剂后,能快速的产生大量气泡,所以 结论就是在20℃(或相同条件下),MnO2可以加快H2O2分解的反应速率。
点评:该题是高考中的常见题型,属于基础性的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,也有利于培养学生规范严谨的实验设计能力。

练习册系列答案
相关题目



 mol电子,写出相应反应的化学方程式_______。
mol电子,写出相应反应的化学方程式_______。 -NMR(核磁共振)可以用于含碳化合物的结构分析。
-NMR(核磁共振)可以用于含碳化合物的结构分析。