题目内容
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)砷的基态原子的电子排布式为 。
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主。Ga和As相比,电负性较大的是 ,GaAs中Ga的化合价为 。
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为 ;
AsH3的沸点高于PH3,其主要原因为 。
(4)Na3AsO4可作杀虫剂。AsO43-的立体构型为 ,与其互为等电子体的分子的化学式为 (任写一种)。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
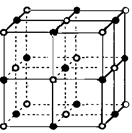
(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图。已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为______g/cm3(只要求列算式,不必计算)。
(1)砷的基态原子的电子排布式为 。
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主。Ga和As相比,电负性较大的是 ,GaAs中Ga的化合价为 。
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为 ;
AsH3的沸点高于PH3,其主要原因为 。
(4)Na3AsO4可作杀虫剂。AsO43-的立体构型为 ,与其互为等电子体的分子的化学式为 (任写一种)。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图。已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为______g/cm3(只要求列算式,不必计算)。

(1)1s22s22p63s23p63d104s24p3 (2分)
(2) As (1分) +3 (1分)
(3)sp3杂化(1分)
AsH3的相对分子质量比PH3的大,分子间作用力大,因而AsH3的沸点比PH3高。(2分,相对分子质量大和分子间作用力大两个给分点各1分。)
(4)正四面体(2分) CF4 SiF4 CCl4 SiCl4等(2分)
(5)H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中的As为+5价,正电性更高,导致As-O-H中的O的电子更向As偏移,越易电离出H+。(2分)
(6)
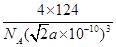 或
或 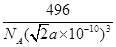 (2分,其他合理答案也可给分)
(2分,其他合理答案也可给分)试题分析:(1)As是33号元素,基态原子核外电子排布为1s22s22p63s23p63d104s24p3。
(2)As、Ga在同一周期,同周期元素电负性自左向右逐渐增大,As在Ga的右面,As的电负性大。As的负化合价为-3,因此Ga的化合价为+3。
(3)AsH3与NH3结构相似,因此AsH3中As的杂化方式为sp3。AsH3、PH3属于分子晶体,相对分子质量越大,熔、沸点越高。
(4)根据ABn型分子构型判断方法,AsO43-的电子对有(5+3)/2=4对,中心原子sp3杂化,因此空间构型为正四面体构型。
5核32电子的分子有CF4 SiF4 CCl4 SiCl4等。
(5)酸性强弱主要看是否容易电离出H+,因此分析出H3AsO4易电离出H+的原因即可。
(6)每一个晶胞中含有的白磷分子数为
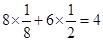 个,晶胞的棱长为
个,晶胞的棱长为 ,每个晶胞的质量为
,每个晶胞的质量为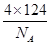 ,因此晶胞的密度为
,因此晶胞的密度为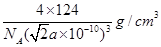 。
。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 mol?L-1,则此溶液不一定呈中性
mol?L-1,则此溶液不一定呈中性 2CO↑+Si ,还原性:Si <C
2CO↑+Si ,还原性:Si <C
 Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2