题目内容
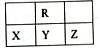
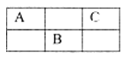
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。

(1)在以上字母表示的短周期主族元素中,原子半径最大的是__________(填元素符号)。
(2)i元素在周期表中的位置是__________。运用元素周期律判断,i元素的正二价硫酸盐是__________(难溶或易溶)于水的固体。
(3)请用电子式表示a与g组成的化合物的形成过程____________________。
(4)X、Y为同周期金属元素,它们简单离子的电子层与d离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的离子方程式____________________;X与d的单质在加热条件下生成的化合物中存在的化学键类型是____________________。
(5)工业上制取Y和g的无水化合物方法如下:Y的氧化物与b、g的单质在高温条件下反应,每消耗6 kg b的单质,过程中转移1×10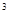 mol电子,写出相应反应的化学方程式_______。
mol电子,写出相应反应的化学方程式_______。

(1)在以上字母表示的短周期主族元素中,原子半径最大的是__________(填元素符号)。
(2)i元素在周期表中的位置是__________。运用元素周期律判断,i元素的正二价硫酸盐是__________(难溶或易溶)于水的固体。
(3)请用电子式表示a与g组成的化合物的形成过程____________________。
(4)X、Y为同周期金属元素,它们简单离子的电子层与d离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的离子方程式____________________;X与d的单质在加热条件下生成的化合物中存在的化学键类型是____________________。
(5)工业上制取Y和g的无水化合物方法如下:Y的氧化物与b、g的单质在高温条件下反应,每消耗6 kg b的单质,过程中转移1×10
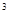 mol电子,写出相应反应的化学方程式_______。
mol电子,写出相应反应的化学方程式_______。(1)Mg(2)第五周期,第ⅡA族 难溶 (3)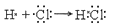
(4)OH-+Al(OH)3=AlO2-+2H2O; 离子键、非极性共价键 (5)Al2O3+3C+3Cl2 2AlCl3+3CO
2AlCl3+3CO
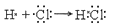
(4)OH-+Al(OH)3=AlO2-+2H2O; 离子键、非极性共价键 (5)Al2O3+3C+3Cl2
 2AlCl3+3CO
2AlCl3+3CO试题分析:根据元素在周期表中的相对位置可知,a是H,b是C, d是O,e是Mg,f是Si,g是Cl,h是Ar,i是Sr。
(1)同周期自左向右,原子半径逐渐减小。同主族自上而下原子半径逐渐增大,所以主族元素中原子半径最大的是Mg。
(2)Sr元素在周期表中的位置是第五正确低ⅡA族。同主族元素性质是相似的,由于碳酸钙、碳酸钡等均是难溶性物质,所以SrCO3也是难溶于水的。
(3)H和Cl两种元素形成共价化合物氯化氢,含有极性键,其形成过程可表示为
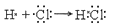 。
。(4)X、Y为同周期金属元素,它们简单离子的电子层与d离子的电子层结构相同,因此X和Y是第三周期的钠、镁和铝等。Y离子半径在同周期元素简单离子半径中最小,因此Y是铝。由于氢氧化铝是两性氢氧化物,能酸或强碱中,因此X是Na,则X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水的离子方程式是OH-+Al(OH)3=AlO2-+2H2O;金属钠和氧气在加热等条件下反应生成过氧化钠,含有离子键和非极性键。
(5)6000g单质碳的物质的量是6000g÷12g/mol=500mol,在反应中转移1000mol电子,所以碳原子的化合价升高到1000mol÷500mol=2,即氧化产物是CO,因此反应的化学方程式是Al2O3+3C+3Cl2
 2AlCl3+3CO。
2AlCl3+3CO。点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目