题目内容
利用15N可以测定亚硝酸盐对地下水质的污染情况。
(1)下列说法正确的是___。
(2)15N的价层电子排布图为_______15NH4Cl的晶胞与CsCl相同,则15NH4Cl晶体中15NH4+的配位数为_______;15NH4+中I5N的杂化轨道类型为_______。
(3) 工业上电解法处理亚硝酸盐的模拟工艺如图。
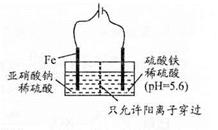
已知:阳极区发生化学反应:
2NO2-+8H++6Fe2+==N2↑ +6Fe3++4HzO
①阳极电极反应方程式是______(不考虑后续反应);
②若硫酸溶液浓度过大,阴极区会有气体逸出,该气体为______(填化学式);该现象表明c( H+ )越大,H+氧化性越______;
③若电解时电路中有0.6 mol电子转移,且NaNO2有剩余,则电解池中生成Na2SO4______mol。
(1)下列说法正确的是___。
| A.14N与15N为同种核素 |
| B.14N的第一电离能小于14C |
| C.15NH3与14NH3均能形成分子间氢键 |
| D.CH315NH2与CH3CH214NH2互为同系物 |
(3) 工业上电解法处理亚硝酸盐的模拟工艺如图。

已知:阳极区发生化学反应:
2NO2-+8H++6Fe2+==N2↑ +6Fe3++4HzO
①阳极电极反应方程式是______(不考虑后续反应);
②若硫酸溶液浓度过大,阴极区会有气体逸出,该气体为______(填化学式);该现象表明c( H+ )越大,H+氧化性越______;
③若电解时电路中有0.6 mol电子转移,且NaNO2有剩余,则电解池中生成Na2SO4______mol。
(13分)(1)CD(2分,各1分,不全对扣1分)(2) (2分)8(1分)sp3杂化(1分)(3)①Fe-2e-=Fe2+(2分)②H2(2分)强(1分)③0.05(2分)
(2分)8(1分)sp3杂化(1分)(3)①Fe-2e-=Fe2+(2分)②H2(2分)强(1分)③0.05(2分)
 (2分)8(1分)sp3杂化(1分)(3)①Fe-2e-=Fe2+(2分)②H2(2分)强(1分)③0.05(2分)
(2分)8(1分)sp3杂化(1分)(3)①Fe-2e-=Fe2+(2分)②H2(2分)强(1分)③0.05(2分)试题分析:(1) 14N与15N质子数相同、中子数不同,互称为同位素,不是同种核素,A错误;同周期元素从左向右,第一电离能总体趋势增大,但IIA和VA反常,第一电离能:N>C,B错误;N电负性大,NH3分子间存在氢键,C正确;同系物指结构相似,分子组成相差n个CH2,D正确。
(2)N价层电子排布为2s22p3,轨道表示式为
 ;CsCl中Cs+和Cl-配位数均为8;15NH4+中N价层电子对数=
;CsCl中Cs+和Cl-配位数均为8;15NH4+中N价层电子对数=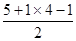 =4,N杂化类型为sp3。
=4,N杂化类型为sp3。(3)① 阳极为Fe,电极反应式为Fe-2e-=Fe2+。②若硫酸浓度过大,阴极发生2H++2e-=H2↑,阴极产生氢气。说明氢离子浓度越大,氧化性越强。③若电解时转移0.6mol电子,则由Fe-2e-=Fe2+得阳极生成0.3molFe2+,由阳极区化学反应得消耗NaNO20.1mol,所以生成硫酸钠0.05mol。

练习册系列答案
相关题目