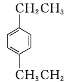
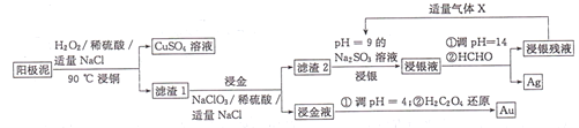
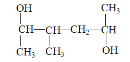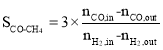题目内容
【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:

下列说法不正确的是( )
A. 前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B. 达到平衡时,需要从外界吸收的能量为0.968 kJ
C. 增大水的浓度,可以改变待反应的限度
D. 使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
【答案】D
【解析】
A. 前20 min内,生成0.0010mol氧气,则消耗0.0020mol水蒸气,水蒸气的浓度变化量为0.0020mol/2L=0.0010mol·L-1,所以v(H2O)=0.0010mol·L-1/20min=5×10-5mol·L-1·min-1,故A不选;
B. 达到平衡时,生成0.0020mol氧气,根据热化学方程式,生成1mol氧气,需要吸收484 kJ的热量,所以生成0.0020mol氧气,需要从外界吸收的能量为484 kJ ×0.0020mol=0.968 kJ,故B不选;
C. 增大水蒸气的浓度,可以使平衡右移,故C不选;
D.氧化亚铜是催化剂,只能加快反应速率,不能使平衡发生移动,所以不能改变平衡时氧气的体积分数,故D选。
故选D。

 寒假学与练系列答案
寒假学与练系列答案【题目】黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题20图-1所示:
① a反应中每生成1molFeSO4转移电子的物质的量为___mol。
② d反应的离子方程式为_______________。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题20图-2
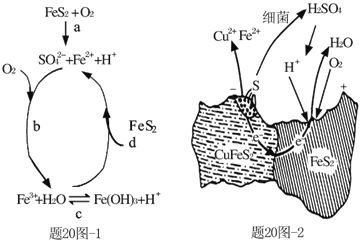
①冶炼过程中,正极周围溶液的pH___(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为___。
这里,否则就错了!!阅后删除! |
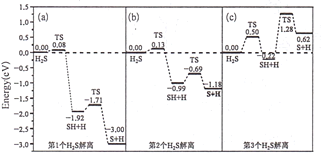
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题20图-3。
相关反应 | 反应热 | 平衡常数K |
FeS2(s) + H2(g) | ΔH1 | K1 |
1/2 FeS2(s) + H2(g) | ΔH2 | K2 |
FeS(s) + H2(g) | ΔH3 | K3 |
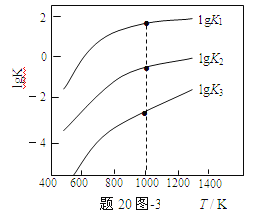
①上述反应中,ΔH1___0(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有___(举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为___。