题目内容
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性溶液中分解产生S、SO2。
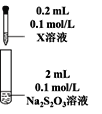
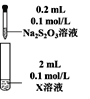
Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得,实验室模拟该工业过程的装置如图所示。
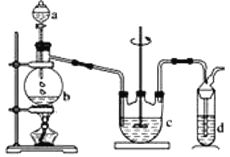
(1)b中反应的离子方程式为____,c中试剂为_____。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_____。
(3)实验中要控制SO2生成速率,可以采取的措施有______(写出两条)。
(4)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是____。
(5)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:_____。
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)
Fe(S2O3)33-(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O32-
装置 | 编号 | 试剂X | 实验现象 |
| ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色, 30s后溶液几乎变为无色 |
② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(6)根据实验①的现象,初步判断最终Fe3+被S2O32-还原为Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:_____。
(7)同浓度氧化性:Ag+ > Fe3+。实验②中Ag+未发生氧化还原反应的原因是____。
(8)进一步探究Ag+和S2O32-反应。
装置 | 编号 | 试剂X | 实验现象 |
| ③ | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:Ag2S2O3+___=Ag2S+___
(9)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和___有关(写出两条)。
【答案】SO32-+2H+=SO2↑+H2O或HSO3-+2H+=SO2↑+H2O 硫化钠和碳酸钠混合溶液 硫 控制反应温度、调节酸的滴加速度(或调节酸的浓度等) 若SO2过量,溶液显酸性,产物分解 取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质 生成紫色配合物的反应速率快,氧化还原反应速率慢;Fe3+与S2O32-氧化还原反应的程度大,Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色。 Ag+与S2O32-生成稳定的配合物,浓度降低,Ag+的氧化性和S2O32-的还原性减弱 H2O H2SO4 阳离子、用量等
Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色。 Ag+与S2O32-生成稳定的配合物,浓度降低,Ag+的氧化性和S2O32-的还原性减弱 H2O H2SO4 阳离子、用量等
【解析】
(1)第一个装置为二氧化硫的制取装置,制取二氧化硫的原料为:亚硫酸钠和70%的浓硫酸,c装置为Na2S2O3的生成装置,d装置为尾气吸收装置,吸收二氧化硫和硫化氢等酸性气体;
(2)反应开始时发生的反应为:Na2S+4SO2+H2O=2H2S+Na2SO3,SO2+2H2S=3S↓+2H2O;
(3)通过控制反应温度、调节酸的滴加速度、调节酸的浓度可以控制SO2生成速率;
(4)硫代硫酸钠遇酸易分解,若通入的SO2过量,则溶液显酸性,硫代硫酸钠会分解;
(5)将产品溶于水后检验溶液中是否含有SO42-即可;
(6)利用铁氰化钾溶液检验反应后的溶液中含有Fe2+;混合后溶液先变成紫黑色,30s后溶液几乎变为无色,说明Fe3++3S2O32-![]() Fe(S2O3)33-反应速率快于Fe3+和S2O32-之间的氧化还原反应,且促进平衡逆向移动;先变成紫黑色后变无色,说明生成紫色配合物的反应速率快,氧化还原反应速率慢;另外Fe3+与S2O32-氧化还原反应的程度大,导致Fe3++3S2O32-
Fe(S2O3)33-反应速率快于Fe3+和S2O32-之间的氧化还原反应,且促进平衡逆向移动;先变成紫黑色后变无色,说明生成紫色配合物的反应速率快,氧化还原反应速率慢;另外Fe3+与S2O32-氧化还原反应的程度大,导致Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色;
Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色;
(7)实验②滴加AgNO3溶液,先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液,说明溶液中Ag+较低,减少了发生氧化还原反应的可能;
(8)Ag2S2O3中S元素化合价为+2价,生成的Ag2S中S元素化合价为-2价,是还原产物,则未知产物应是氧化产物,结合电子守恒,原子守恒分析即可;
(9)结合试验①、②、③从阳离子的氧化性、离子浓度等方面分析。
该实验在容器b中制取SO2,在容器c中制取Na2S2O3,装置d用来吸收尾气中的SO2防止污染空气。
(1)第一个装置为二氧化硫的制取装置,制取二氧化硫的原料为:亚硫酸钠或亚硫酸氢钠和70%的浓硫酸,反应的离子方程式为:SO32-+2H+=SO2↑+H2O或HSO3-+2H+=SO2↑+H2O;c装置为Na2S2O3的生成装置,根据反应原理可知容器c中的试剂为硫化钠和碳酸钠混合溶液,故答案为:SO32-+2H+=SO2↑+H2O或HSO3-+2H+=SO2↑+H2O,硫化钠和碳酸钠混合溶液。
(2)反应开始时发生的反应为:Na2S+4SO2+H2O=2H2S+Na2SO3,SO2+2H2S=3S↓+2H2O;反应生成的硫单质使溶液变浑浊,故答案为:硫。
(3)控制反应温度、调节酸的滴加速度、调节酸的浓度等都可以控制SO2的生成速率,故答案为:控制反应温度、调节酸的滴加速度(或调节酸的浓度等)。
(4)硫代硫酸钠遇酸易分解,若通入的SO2过量,则溶液显酸性,硫代硫酸钠会分解,故答案为:若SO2过量,溶液显酸性,产物分解。
(5)检测产品中是否存在Na2SO4的方法是取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,故答案为:取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质。
(6)实验①的现象是混合后溶液先变成紫黑色,30s后溶液几乎变为无色,取反应后的混合液并加入铁氰化钾溶液,产生蓝色沉淀,则有Fe2+生成,可判断为Fe3+被S2O32-还原为Fe2+,说明Fe3++3S2O32![]() Fe(S2O3)33-反应速率快于Fe3+和S2O32-之间的氧化还原反应,且促进平衡逆向移动;先变成紫黑色后变无色,说明生成紫色配合物的反应速率快,氧化还原反应速率慢;另外Fe3+与S2O32-氧化还原反应的程度大,导致Fe3++3S2O32-
Fe(S2O3)33-反应速率快于Fe3+和S2O32-之间的氧化还原反应,且促进平衡逆向移动;先变成紫黑色后变无色,说明生成紫色配合物的反应速率快,氧化还原反应速率慢;另外Fe3+与S2O32-氧化还原反应的程度大,导致Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色,故答案为:生成紫色配合物的反应速率快,氧化还原反应速率慢;Fe3+与S2O32-氧化还原反应的程度大,Fe3++3S2O32-
Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色,故答案为:生成紫色配合物的反应速率快,氧化还原反应速率慢;Fe3+与S2O32-氧化还原反应的程度大,Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色。
Fe(S2O3)33-(紫黑色)平衡逆移,最终溶液几乎无色。
(7)同浓度氧化性:Ag+>Fe3+,但实验②为发生Ag+与S2O32-之间的氧化还原反应,结合实验现象先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液,说明Ag+与S2O32-生成稳定的配合物,浓度降低,Ag+的氧化性和S2O32-的还原性减弱,故答案为:Ag+与S2O32-生成稳定的配合物,浓度降低,Ag+的氧化性和S2O32-的还原性减弱。
(8)Ag2S2O3中S元素化合价为+2价,生成的Ag2S中S元素化合价为-2价,是还原产物,则未知产物应是氧化产物,如果产物是H2SO3,能被Ag+继续氧化,则氧化产物应为H2SO4,结合原子守恒可知,另一种反应物应为H2O,发生反应的化学方程式为AgS2O3+H2O=Ag2S+ H2SO4,故答案为:H2O、H2SO4。
(9)结合试验①、②、③可知,Na2S2O3与金属阳离子发生氧化还原反应和金属阳离子的氧化性强弱、离子浓度大小,反应物的用量等有关,故答案为:阳离子、用量等。

 阅读快车系列答案
阅读快车系列答案