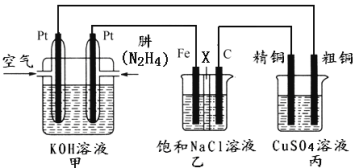
题目内容
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24LHF所含分子数为0.1NA
B. 某温度下,2LpH=12的NaOH溶液中含OH-的数目为0.02NA
C. 化学反应中每生成1molO2,转移的电子数为4NA
D. 丙烯和环丙烷组成的42g混合气体分子中共用电子对总数为9NA
【答案】D
【解析】
A.标准状况下,HF是液体,不可用22.4L/mol计算,故A错误;
B.温度未知,Kw未知,无法计算OH-的数目,故B错误;
C.化学反应中每生成1molO2,转移的电子数不一定是4NA,例如H2O2制氧气,每生成1molO2,转移的电子数为2NA,故C错误;
D.丙烯和环丙烷属于同分异构体,最简式为CH2,则可通过最简式进行计算,n(CH2)=![]() =3mol,共用电子对3×(4+2)÷2=9mol,数目为9NA,故D正确;
=3mol,共用电子对3×(4+2)÷2=9mol,数目为9NA,故D正确;
正确答案:D。

 阅读快车系列答案
阅读快车系列答案【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取 50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH 溶液,并用另一温度计测出其温度;③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)倒入 NaOH 溶液的正确操作是_____(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与 NaOH 溶液混合均匀的正确操作是_____(填序号)。
A.用温度计小心搅拌 B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为 ΔH1、ΔH2、ΔH3,则 ΔH1、ΔH2、ΔH3 的大小关系为______________________。
(4)假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容 c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度 t1/ ℃ | 终止温度 t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热 ΔH=_____(结果保留一位小数)。_____(填“能”或“不能”)用 Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_____。