题目内容
8.40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )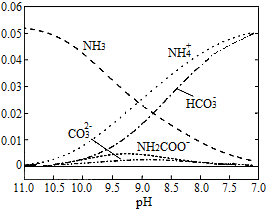
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 随着CO2的通入,c(OH−)c(NH3•H2O)不断增大 | |
| D. | 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成 |
分析 A.根据pH=9时,图象中各种离子浓度的大小关系分析;
B.溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度;
C.根据Kb=c(NH4+)c(OH−)c(NH3•H2O)分析;
D.根据图象可知开始没有NH2COO-,后来也不存在NH2COO-.
解答 解:A.pH=9时,图象中各种离子浓度的大小关系:c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-),故A正确;
B.溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度,则不同pH的溶液中存在电荷守恒关系为:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-),故B正确;
C.已知Kb=c(NH4+)c(OH−)c(NH3•H2O),温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则c(OH−)c(NH3•H2O)不断减小,故C错误;
D.由图象可知开始没有NH2COO-,后来也不存在NH2COO-,所以NH2COO-为中间产物,即在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成,故D正确.
故选C.
点评 本题考查了溶液中离子浓度大小比较、电荷守恒的应用、图象的分析与应用等,题目难度中等,侧重于考查学生对图象的分析与应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.化学是你,化学是我,化学深入我们生活.下列说法正确的是( )
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | PX项目的主要产品对二甲苯属于饱和烃 |
19.下列物质在生话中应用时,起还原作用的是( )
| A. | 明矾作净水剂 | B. | 甘油作护肤保湿剂 | ||
| C. | 漂粉精作消毒剂 | D. | 铁粉作食品袋内的脱氧剂 |
16.下列制作铅笔的材料与相应工业不对应的是( )
| A. | 橡皮擦--橡胶工业 | B. | 铝合金片--冶金工业 | ||
| C. | 铅笔芯--电镀工业 | D. | 铅笔漆--涂料工业 |
3.下列说法不正确的是( )
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
13.进行化学实验时应强化安全意识.下列做法正确的是( )
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片 |
20.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3•H2O调节pH=8可除去Fe3+(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为b(V0−V1)ymol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3•H2O调节pH=8可除去Fe3+(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为b(V0−V1)ymol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).
14.室温下,下列溶液中粒子浓度大小关系正确的是( )
| A. | Na2S溶液中,2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| B. | 强碱弱酸盐NaA溶液的pH=8,则c(OH-)-c(HA)=1,0×10-8mol/L | |
| C. | KAl(SO4)2溶液中,c(SO42-)>c(K+)=c(Al3+)>c(H+)>c(OH-) | |
| D. | 向100ml pH=12 的 NaOH溶液中加入pH=2的醋酸溶液至中性,所得溶液的总体积大于200ml |
15.下列说法正确的是( )
| A. | HClO2→ClO2+Cl2+H2O(未配平),1 mol HClO2分解时转移电子的物质的量为1 mol | |
| B. | 标准状况下,14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA | |
| C. | 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+ | |
| D. | 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为:2CaCO3+O2+2SO2高温_2CaSO3+2CO2 |