题目内容
下列实验操作或事实与预期实验目的或所得结论一致的是( )
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 取少量试液于试管中,加入用HNO3酸化的BaCl2溶液,产生白色沉淀 | 说明试液中一定含有SO42- |
| B | 分别向两支试管中加入等体积、等浓度的过氧化氢溶液,再在其中一支试管中加入少量MnO2 | 研究催化剂对过氧化氢分解速率的影响 |
| C | 将NaHCO3与HCl两种溶液相互滴加 | 可以鉴别这两种溶液 |
| D | C2H5Br与AgNO3溶液混合加热 | 检验C2H5Br中的溴元素 |
B
试题分析:检验SO42- 应先加过量HCl,再加BaCl2溶液,所以A项操作错误;B项对比试验操作结论都正确;NaHCO3与HCl两种溶液相互滴加都能立刻观察到有气泡产生,现象相同,不能用此法鉴别这两种溶液,C错误;检验溴乙烷中的溴元素应该在碱性条件下先水解,中和碱后再加硝酸银进行检验,所以D操作错误;故选B。

练习册系列答案
相关题目
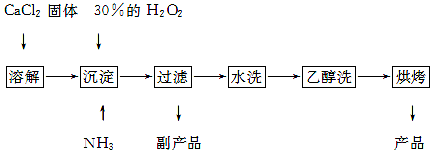
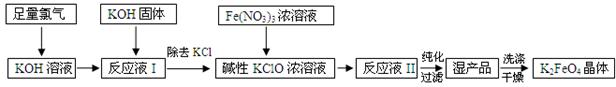
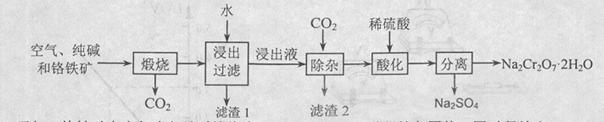
 2NaAlO2+CO2↑。请回答:
2NaAlO2+CO2↑。请回答: ,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准。
,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准。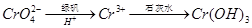 。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式 。
。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式 。
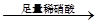 无沉淀
无沉淀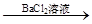 白色沉淀
白色沉淀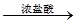 气体
气体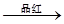 褪色
褪色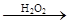 棕黄色溶液
棕黄色溶液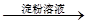 蓝色溶液
蓝色溶液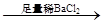 白色沉淀
白色沉淀 沉淀溶解
沉淀溶解