题目内容
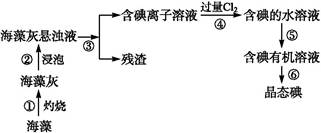
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
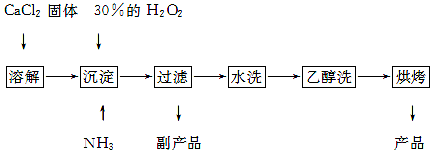
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
① ;
② 。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①CaO2的质量分数为 (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是 。

已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
① ;
② 。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①CaO2的质量分数为 (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是 。
(1)CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl
(2)可取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀
(3)①温度低可减少过氧化氢的分解,提高过氧化氢的利用率
②温度低有利于晶体的析出
(4)① ②偏高 ③滴速太慢,S2O32-(或I-)在滴定过程中被氧气氧化
②偏高 ③滴速太慢,S2O32-(或I-)在滴定过程中被氧气氧化
(2)可取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀
(3)①温度低可减少过氧化氢的分解,提高过氧化氢的利用率
②温度低有利于晶体的析出
(4)①
 ②偏高 ③滴速太慢,S2O32-(或I-)在滴定过程中被氧气氧化
②偏高 ③滴速太慢,S2O32-(或I-)在滴定过程中被氧气氧化试题分析:(1)由流程可知,反应物为氯化钙、双氧水、氨气和水,生成为CaO2·8H2O和氯化铵,反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl;
(2)验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)由于双氧水受热易分解,所以温度低可减少过氧化氢的分解,提高过氧化氢的利用率;另一方面该反应是放热反应,温度低有利于提高CaO2·8H2O产率。
(4)①CaO2具有氧化性,能被碘化钾氧化生成单质碘,方程式为CaO2+2KI+2H2SO4=CaSO4+K2SO4+I2+2H2O。所以根据方程式可知CaO2~2Na2S2O3,因此CaO2的物质的量是0.0005cVmol,所以CaO2的质量分数为
 。
。②如果滴速过慢,而空气中的氧气在酸性条件下也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高。

练习册系列答案
相关题目