题目内容
【题目】用惰性电极电解CuSO4 和KNO3的混合溶液500mL,经过一段时间后,两极均得到标准状况下11.2L的气体,则原混合液中CuSO4的物质的量浓度为( )
A.0.5 molL﹣1B.0.8 molL﹣1C.1.0 molL﹣1D.1.5 molL﹣1
【答案】C
【解析】
用惰性电极电解含CuSO4和KNO3混合溶液,溶液中阳离子放电顺序Cu2+>H+,阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH--4e-=2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu、2H++2e-=H2↑,依据两极生成气体物质的量结合电解过程中电子守恒计算便可求解。
用惰性电极电解含CuSO4和KNO3混合溶液,在两极均生成标准状况下的气体11.2L,气体的物质的量为n=![]() =0.5mol,溶液中阳离子放电顺序Cu2+>H+,阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH4e=2H2O+O2↑,生成0.5molO2,需电子为4×0.5mol=2mol;
=0.5mol,溶液中阳离子放电顺序Cu2+>H+,阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH4e=2H2O+O2↑,生成0.5molO2,需电子为4×0.5mol=2mol;
阴极电极反应为:Cu2++2e=Cu、2H++2e=H2↑,生成0.5molH2,需0.5mol×2=1mol电子,依据电子守恒,铜离子得到电子1mol,反应的铜离子物质的量0.5mol,所以Cu2+的物质的量浓度![]() ,则原混合液中CuSO4的物质的量浓度为1.0 molL﹣1,
,则原混合液中CuSO4的物质的量浓度为1.0 molL﹣1,
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】研究CO、CO2的回收对减少碳的排放、改善生态环境和构建生态文明具有重要的意义。回答下列问题:
(1)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH=99 kJ·mol1
CH3OH(g) ΔH=99 kJ·mol1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ·mol1
CO(g)+H2O(g) ΔH=+41 kJ·mol1
则反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=_________。
CH3OH(g)+H2O(g) ΔH=_________。
(2)向容积相同的三个恒容密闭容器中分别通入一定量H2、CO,控制适当条件使其发生反应:2H2(g)+CO(g)![]() CH3OH(g),反应中有关数据如下表所示:
CH3OH(g),反应中有关数据如下表所示:
容器 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | |
c(H2) | c(CO) | c(CH3OH) | ||
A | 350 | 0.40 | 0.20 | 0.16 |
B | 350 | 0.80 | 0.40 | |
C | T | 0.40 | 0.20 | 0.05 |
反应从开始到达到平衡时,平均反应速率:容器A____容器C(填“>”或“<”,后同),容器B中CO的转化率____80%。
(3)①CO2和H2在一定条件下能发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
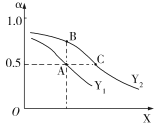
X表示___(填“温度”或“压强”),状态A、B、C对应的平衡常数K(A)、K(B)、K(C)的相对大小顺序为_____。
②向M、N两个初始容积相同的密闭容器中各充入2 mol CO2 和6 mol H2,控制适当条件使其发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
(4)用NaOH溶液做碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=10的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(
)=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
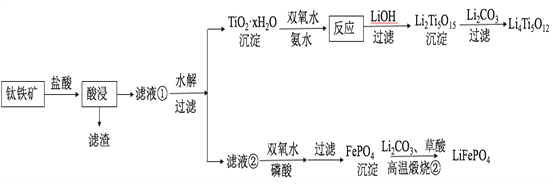
回答下列问题:
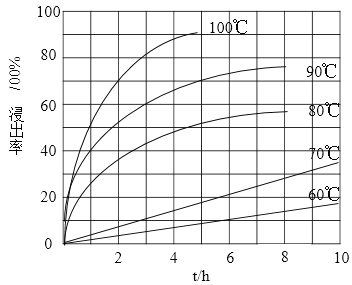
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
【题目】水是生命的源泉、工业的血液、城市的血脉。要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在T ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=________ mol·L-1。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为____________________,由水电离出的c(OH-)=________mol·L-1。
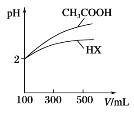
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
在25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。

