题目内容
15.下列反应中,生成物所贮的化学能比反应物所贮化学能要多的是( )| A. | CaO+H2O=Ca(0H)2 | B. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2 |
分析 依据化学反应能量守恒,生成物所贮的化学能比反应物所贮化学能要多,说明该反应为吸热反应;
解答 解:A、CaO+H2O=Ca(0H)2 为化合反应属于放热反应,生成物所贮的化学能比反应物所贮化学能要少,故A不符合;
B、C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO为吸热反应,生成物所贮的化学能比反应物所贮化学能要多,故B符合;
C、CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O是燃烧反应,属于放热反应,生成物所贮的化学能比反应物所贮化学能要少,故C不符合;
D、2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2 是放热反应,生成物所贮的化学能比反应物所贮化学能要少,故D不符合;
故选B.
点评 本题考查了化学反应能量变化,吸热放热的判断依据,掌握基础是关键,题目较简单.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
相关题目
3.室温下,下列溶液的离子浓度关系式正确的是( )
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | pH=10的Na2CO3溶液:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+$\frac{1}{2}$c(C2O42-) | |
| D. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
10.下列措施对增大反应速率明显有效的是( )
| A. | Al在氧气中燃烧生成Al2O3,将Al粉改为Al片 | |
| B. | Fe与稀盐酸反应制取H2时,加入少量醋酸钠粉末 | |
| C. | Na与水反应时增大钠的用量 | |
| D. | 灼热的碳与水蒸气反应时,向体系中通入水蒸气 |
7.下列各项表达式正确的是( )
| A. | N2的电子式: | B. | F-的结构示意图: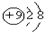 | ||
| C. | 二氧化碳分子的结构式为 O-C-O | D. | NaCl的电子式: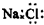 |
4.下列变化过程,属于放热过程的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥NH4Cl晶体与Ba(OH)2•8H2O混合搅拌.
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥NH4Cl晶体与Ba(OH)2•8H2O混合搅拌.
| A. | ②③④⑥ | B. | ①②⑥ | C. | ②③④⑤ | D. | ①③⑤ |
5.下列变化中,原物质分子内共价键被破坏,同时有离子键生成的是( )
| A. | 二氧化硅与氢氧化钠溶液 | B. | 氯化氢溶于水 | ||
| C. | 氯化氢与氨反应 | D. | 锌与稀硫酸反应 |
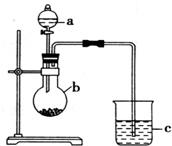 “元素的最高价氧化物对应的水化物酸性越强非金属性越强”某同学欲运用这一观点来验证硫和碳两元素的得电子的能力强弱,设计实验如图所示,请回答:
“元素的最高价氧化物对应的水化物酸性越强非金属性越强”某同学欲运用这一观点来验证硫和碳两元素的得电子的能力强弱,设计实验如图所示,请回答: