题目内容
【题目】如下图所示:向饱和![]() 溶液中逐滴加入稀硫酸,不断搅拌至过量。
溶液中逐滴加入稀硫酸,不断搅拌至过量。
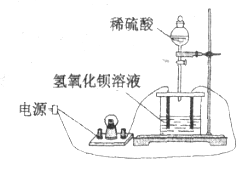
(1)主要的实验现象:烧杯中____________, 灯泡__________________。
(2)烧杯中反应的离子方程式:________________。
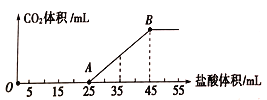
(3)下列图示能正确表示实验过程的是___________(填序号)。
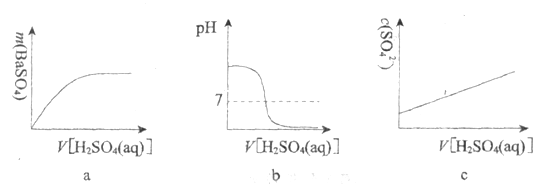
【答案】 产生白色沉淀 由亮变暗直至熄灭,后来又逐渐变亮 ![]() ab
ab
【解析】试题分析:本题以Ba(OH)2和H2SO4的反应为载体,考查实验现象的描述,离子方程式的书写,图像分析。开始为Ba(OH)2溶液,Ba(OH)2属于强碱,溶液中导电离子为Ba2+、OH-;加入H2SO4,发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,BaSO4难溶于水,H2O难电离,溶液中离子物质的量浓度减小,导电能力减弱;当两者恰好完全反应时,溶液中离子浓度接近0,导电能力接近0;继续加入H2SO4,H2SO4属于强酸,溶液中离子物质的量浓度增加,导电能力又增强。
(1)烧杯中的现象是产生白色沉淀;灯泡由亮变暗直至熄灭,后来又逐渐变亮。
(2)烧杯中的反应为Ba(OH)2+H2SO4=BaSO4↓+2H2O,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O。
(3)a项,随着硫酸的加入,BaSO4的质量逐渐增大,当Ba(OH)2与H2SO4恰好完全反应时BaSO4质量达最大,继续加入硫酸,BaSO4不再变化,正确;b项,随着硫酸的加入发生酸碱中和反应,溶液的pH减小,恰好完全反应时pH发生突变,硫酸过量后溶液呈酸性,正确;c项,开始溶液中SO42-为0,在Ba(OH)2没有完全反应之前,加入的SO42-与Ba2+形成难溶于水的BaSO4沉淀,溶液中c(SO42-)=0,Ba(OH)2完全反应后溶液中SO42-才逐渐增多,错误;答案选ab。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案