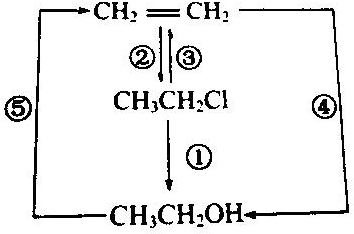
题目内容
6.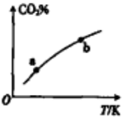 向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)?HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示.下列物理量中,a点大于b点的是 ( )
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)?HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示.下列物理量中,a点大于b点的是 ( )①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数.
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
分析 根据图象可知,可逆反应CO2(g)+H2(g)?HCOOH(g)随着温度升高,二氧化碳含量增大,说明该反应为放热反应;温度越高,反应速率越大,则a点的正逆反应速率都小于b点;HCOOH(g)为生成物,二氧化碳、氢气为反应物,则二氧化碳百分含量越大,则氢气含量越大、甲酸含量越小,则a点甲酸的浓度大于b点,据此进行解答.
解答 解:根据图象可知,可逆反应CO2(g)+H2(g)?HCOOH(g)随着温度升高,二氧化碳含量增大,说明该反应为放热反应,
A.温度升高,反应速率增大,a点温度小于b,则a点的正反应速率一定小于b,故A错误;
B.b点温度大于a点,则正逆反应速率a点小于b点,故B错误;
C.甲酸为生成物,二氧化碳为反应物,则二氧化碳百分含量越大,甲酸浓度越小,b点二氧化碳百分含量大于a点,则a点甲酸的浓度大于b点,故C正确;
D.该反应为放热反应,升温平衡逆向移动,温度越高平衡常数越小,所以a点的平衡常数大于b点,故D错误;
故选C.
点评 本题考查了百分含量随温度变化的曲线、可逆反应的影响因素,题目难度不大,注意掌握外界条件对化学平衡的影响,正确分析图象中曲线变化为解答本题的关键,试题培养了学生分析、理解图象信息的能力.

练习册系列答案
相关题目
17.生活中处处有化学,下列叙述错误的是( )
| A. | 用燃烧法可鉴别羊毛制品相涤纶制品 | |
| B. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 | |
| C. | 严禁乱弃废电池,防止重金属污染土壤和水源 | |
| D. | 某些食品的包装袋内常放人一小包生石灰作干燥剂 |
14.下列图示实验正确的是( )
| A. |  | B. |  | C. |  | D. |  |
11.如图图象与对应的叙述相符的是( )

| A. | 图I表示盐酸滴加到0.1mol/L某碱溶液中得到的滴定曲线,由图I可知二者恰好中和时,所得溶液的pH=7 | |
| B. | 图II表示一定条件下进行的反应2SO2+O2?2SO3△H<0各成分的物质的量变化,t2时刻改变的条件可能是加压或降低温度 | |
| C. | 图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20ml Ba(OH)2溶液时,沉淀是Al(OH)3与BaSO4的混合物 | |
| D. | 图IV表示向一定体积含等浓度NH4Cl、AlCl3、MgCl2混合溶液中逐渐加入NaOH溶液至过量的过程中,生成沉淀的质量与加入NaOH溶液的体积之间的关系 |
18.下列有关物质的实验操作、现象及结论描述正确的是( )
| 选项 | 实验操作及现象 | 结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中一定含有钾元素,可能含钠元素 |
| B | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32- |
| C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
| D | 向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度大于Mg(OH)2的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
15.某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的HCO3-、CO32-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

| A. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 | |
| B. | V1:V2=l:5 | |
| C. | M点时生成的CO2为0.05mol | |
| D. | e曲线表示的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
16.在无色酸性溶液中能大量共存的离子组是( )
| A. | NH4+、Fe3+、SO42-、Cl- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、NO3- |
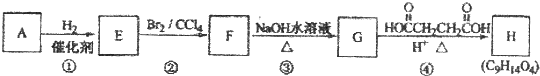
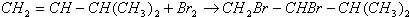 ;
;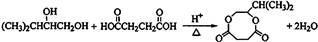 .
.