题目内容
16.A-H有机化合物A~H的转换关系如下所示: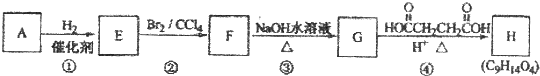
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量为68,则A的分子式为C5H8,名称是:3-甲基-1-丁炔.
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E.由E转化为F的化学方程式是
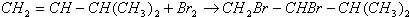 ;
;(3)①的反应类型是加成反应;③的反应类型是取代反应.
(4)G与金属钠反应能放出气体,由G转化为H的化学方程式是
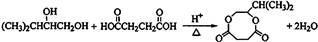 .
.
分析 A和氢气发生加成反应生成E、E和溴发生加成反应生成F,F和氢氧化钠的水溶液发生取代反应生成G,G发生酯化反应生成H,整个流程图中从A到G碳原子个数不变,所以A中含有5个碳原子;链烃A的相对分子质量为68,设A的分子式为C5Hx,故12×5+x=68,x=8,所以A的分子式为C5H8,A含有支链且只有一个官能团,不饱和度=$\frac{5×2+2-8}{2}$=2,含有C≡C,所以A是3-甲基-1-丁炔,结构简式为HC≡CCH(CH3)2;A与等物质的量的H2反应生成E,则E是结构简式为CH2=CHCH(CH3)2;E和溴发生加成反应生成F,所以F的结构简式为: ,F和氢氧化钠的水溶液发生取代反应生成G,G的结构简式为
,F和氢氧化钠的水溶液发生取代反应生成G,G的结构简式为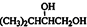 ,G和1,4-丁二酸反应生成H,H的结构简式为:
,G和1,4-丁二酸反应生成H,H的结构简式为: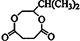 ,据此分析解答.
,据此分析解答.
解答 解:A和氢气发生加成反应生成E、E和溴发生加成反应生成F,F和氢氧化钠的水溶液发生取代反应生成G,G发生酯化反应生成H,整个流程图中从A到G碳原子个数不变,所以A中含有5个碳原子;链烃A的相对分子质量为68,设A的分子式为C5Hx,故12×5+x=68,x=8,所以A的分子式为C5H8,A含有支链且只有一个官能团,不饱和度=$\frac{5×2+2-8}{2}$=2,含有C≡C,所以A是3-甲基-1-丁炔,结构简式为HC≡CCH(CH3)2;A与等物质的量的H2反应生成E,则E是结构简式为CH2=CHCH(CH3)2;E和溴发生加成反应生成F,所以F的结构简式为: ,F和氢氧化钠的水溶液发生取代反应生成G,G的结构简式为
,F和氢氧化钠的水溶液发生取代反应生成G,G的结构简式为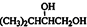 ,G和1,4-丁二酸反应生成H,H的结构简式为:
,G和1,4-丁二酸反应生成H,H的结构简式为: ,
,
(1)通过以上分析知,A的分子式为C5H8,名称是:3-甲基-1-丁炔,故答案为:C5H8;3-甲基-1-丁炔;
(2)E和溴发生加成反应生成F,由E转化为F的化学方程式是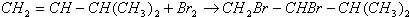 ,
,
故答案为: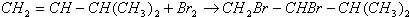 ;
;
(3)通过以上分析知,①的反应类型是加成反应;③的反应类型是取代反应,故答案为:加成反应;取代反应;
(4)G转化为H的化学方程式是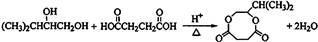 ,
,
故答案为: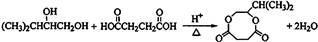 .
.
点评 本题考查有机物推断,为高考高频点,正确推断A结构是解本题关键,侧重考查学生分析、推断能力,明确从A到G碳原子个数不变即可解答,知道常见有机物官能团及其性质、反应条件等,题目难度不大.

(1)一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)△H<0达到平衡.其他条件不变时,下列措施能提高NO2转化率的是BC(填字母).
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g)△H=a kJ/mol-1
为进一步研究NH3生成量与温度的关系,测得常压下达到平衡时部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(3)利用液氨合成尿素的反应在进行时分为如下两步.第一步:2NH3+CO2?H2NCOONH4,第二步:H2NCOONH4?H2O+H2NCONH2.在一体积为0.5L密闭容器中投入4.0mol液氨和1.0mol二氧化碳,实验测得反应中各组分随时间的变化如图1所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第2步反应决定,总反应进行到约55 min时到达平衡.
②反应进行到l0min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=0.148 mol/(L•min).
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图2:
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.

(5)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
2NO2(g)?N2O4(g)△H=-56.9kJ•mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-810.1kJ/mol.
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.右图是通过光电转化原理以廉价原料制备新产品的示意图.写出上述光电转化过程的化学反应方程式2CO2+2H2O$\frac{\underline{\;光照\;}}{\;}$2HCOOH+O2.催化剂a、b之间连接导线上电子流动方向是a→b(填a→b或b→a).
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| C. | 定容时观察液面俯视 | |
| D. | 定容加水超过刻度线又吸出少量 |
(1)硅有非常重要的用途,请写出其中的一种制半导体、制电路板、制太阳能电池板、制硅钢等.
(2)古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是D.
A.可用氧化物形式表示为BaO•CuO•2SiO2
B.性质稳定,不易脱色
C.x等于6
D.易溶解于强酸和强碱
(3)工业上提纯硅有多种路线,其中一种工艺流程示意图如下:
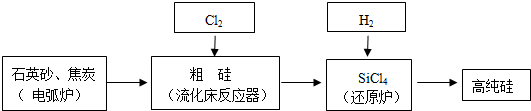
①在电弧炉中发生的反应需要在高温条件进行,写出该反应化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,再利用化学反应进行的方向的知识判断该反应的△H>0(填<、>或=).
②SiCl4极易水解,其完全水解的化学方程式为SiCl4+3H2O=H2SiO3↓+4HCl.
③在流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等,有关物质的沸点数据如下表,分离SiCl4和其他杂质的方法为蒸馏(精馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:
实验装置如图1所示.(固定装置已略去)
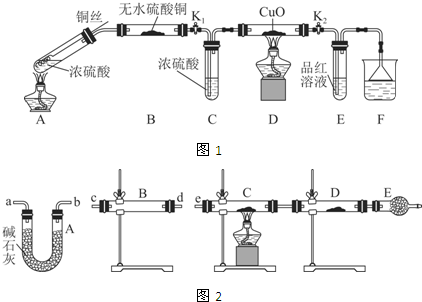
(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)F烧杯中的溶液通常是NaOH溶液(或酸性KMnO4溶液等).
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝.
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(1)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(2)某同学用下列装置(如图2)连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).
(3)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
 化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.
化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.已知:①Cu2++HCHO+30H-=Cu+HCOO-+2H20;
②还原性:HCHO>M(一种金属)>Cu.
下列说法正确的是( )
| A. | 反应之前,应将含OH-的HCHO溶液加人到装置的左侧 | |
| B. | 右侧发生的电极反应式:HCH0-2e-+H20=HC0O-+3H+ | |
| C. | 若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移 | |
| D. | 放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现 |
| A. | 常温下,1mol丙烯中含碳原子数为3NA | |
| B. | 常温下,pH=13的NaOH溶液中含OH-数目为NA | |
| C. | 23gNa与足量氧气反应时转移的电子数为2NA | |
| D. | 标准状况下,22.4LCHCl3中含C-H键数目为NA |
 .
.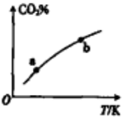 向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)?HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示.下列物理量中,a点大于b点的是 ( )
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)?HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示.下列物理量中,a点大于b点的是 ( )