题目内容
11.如图图象与对应的叙述相符的是( )
| A. | 图I表示盐酸滴加到0.1mol/L某碱溶液中得到的滴定曲线,由图I可知二者恰好中和时,所得溶液的pH=7 | |
| B. | 图II表示一定条件下进行的反应2SO2+O2?2SO3△H<0各成分的物质的量变化,t2时刻改变的条件可能是加压或降低温度 | |
| C. | 图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20ml Ba(OH)2溶液时,沉淀是Al(OH)3与BaSO4的混合物 | |
| D. | 图IV表示向一定体积含等浓度NH4Cl、AlCl3、MgCl2混合溶液中逐渐加入NaOH溶液至过量的过程中,生成沉淀的质量与加入NaOH溶液的体积之间的关系 |
分析 A.根据图象可知,0.1mol/L的该碱溶液的pH=11,说明该碱为弱电解质,恰好反应时生成强酸弱碱盐,溶液显示酸性;
B.达到平衡后,t2时刻SO2和O2物质的量减小,SO3物质的量增大,化学平衡向正反应方向移动,据此判断改变的条件;
C.将Ba(OH)2溶液逐渐滴加入到明矾溶液中,当Al3+完全沉淀时,离子方程式为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓;当SO42-完全沉淀时,离子方程式为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,以此进行判断;
D、根据离子性质可知,开始是Al3+、Mg2+沉淀所消耗的NaOH溶液,图象开始有测定生成,沉淀完全后是NH4+消耗的NaOH,图象中出现平台,随后氢氧化铝沉淀溶解是Al(OH)3所消耗的NaOH.
解答 解:A.当盐酸的体积为0时,0.1mol/L的碱溶液的pH=11,说明该碱为弱碱,与盐酸恰好反应时生成强酸弱碱盐,溶液显示酸性,溶液的pH<7,故A错误;
B.达到平衡后,t2时刻后SO2和O2物质的量减小,SO3物质的量增大,化学平衡向正反应方向移动,若加压,平衡正向进行,若降低温度,由于△H<0,该反应是放热反应,平衡会向着正向移动,与图象变化相符,故B正确;
C.假设为明矾(KAl(SO4)2)为1mol,当Al3+完全沉淀时,离子方程式为2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,沉淀的质量为m(Al(OH)3)+m(BaSO4)=1mol×78g/mol+1.5mol×233g/mol=427.5g,当SO42-完全沉淀时,离子方程式为Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,沉淀的质量为m(BaSO4)=2mol×233g/mol=466g,所以在加入20mL Ba(OH)2溶液时,沉淀的质量达到最大,氢氧化铝完全溶解,沉淀为硫酸钡,故C错误;
D、根据离子性质可知,开始是Al3+、Mg2+沉淀所消耗的NaOH溶液,图象开始有测定生成,沉淀完全后是NH4+消耗的NaOH,图象中出现平台,随后氢氧化铝沉淀溶解是Al(OH)3所消耗的NaOH;反应的离子方程式:Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓;NH4++OH-=NH3•H2O;Al(OH)3+OH-=AlO2-+2H2O,图象不符合,故D错误;
故选B.
点评 本题考查化学反应中图象的变化,涉及了弱电解质的电离平衡、化学平衡及其影响因素等知识,题目难度中等,注意解化学平衡图象题要注意“四看”:一看点:看起点、交点、拐点等;二看线:看线的走向和变化趋势:三看面:看清横坐标和纵坐标表示的物理量;四看要不要作辅助线:看是否需要作等温线或等压线.

| 选项 | 离子或分子 | 要求 |
| A | Mg2+、SO42-、Cl-、NO3- | c(Mg2+)=c(SO42-) |
| B | Na+、Cu2+、I-、NH3•H2O | 在酸性高锰酸钾溶液中 |
| C | NH4+、Al3+、Cl-、NO3- | 滴加氨水有沉淀产生 |
| D | Cl-、Na+、Cr2O72-、C2H5OH | 溶液无色透明且遇甲基橙显红色 |
| A. | A | B. | B | C. | C | D. | D |
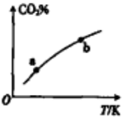 向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)?HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示.下列物理量中,a点大于b点的是 ( )
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)?HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示.下列物理量中,a点大于b点的是 ( )①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数.
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
| A. | 与浓氢溴酸卤代 | B. | 与浓硫酸共热消去 | ||
| C. | 铜催化氧化 | D. | 与戊酸催化酯化 |
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220kJ/mol
7molH2与C3H8混合物完全燃烧,共放热5869kJ,则二者的体积比V(H2):V(C3H8)为( )
| A. | 1:1 | B. | 2:5 | C. | 3:4 | D. | 5:2 |
| A. | 常温常压下,16gO2中含有的氧分子数为NA | |
| B. | 1molOH-中含有的电子数为10NA | |
| C. | 标准状况下,11.2LH2O中含有的氢原子数为NA | |
| D. | 1mol/LBaCl2溶液中含有的钡离子数为NA |
 .
.