题目内容
1.已知:氯乙烷跟化合物之间的转化如图所示: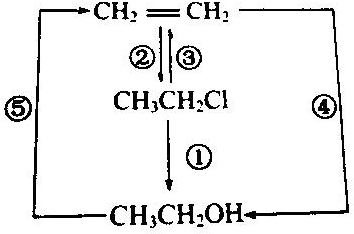
请写出各反应的化学方程式:①CH3CH2Cl+H2O$→_{△}^{NaOH}$CH3CH2OH+HCl②CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl③CH3CH2Cl$→_{△}^{NaOH/乙醇}$CH2=CH2+HCl④CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH⑤CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
分析 CH3CH2Cl含有-Cl,可在氢氧化钠水溶液中加热生成乙醇,在氢氧化钠乙醇溶液中加热发生消去反应生成乙烯,乙烯含有碳碳双键,可发生加成反应生成氯乙烷、乙醇,乙醇可发生消去反应生成乙烯,以此解答该题.
解答 解:①为CH3CH2Cl生成乙醇的反应,可在氢氧化钠水溶液中加热生成,反应的方程式为CH3CH2Cl+H2O$→_{△}^{NaOH}$CH3CH2OH+HCl;
②为CH2=CH2与HCl的加成反应,反应的方程式为CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl;
③为CH3CH2Cl的消去反应,在氢氧化钠乙醇溶液中加热发生,方程式为CH3CH2Cl$→_{△}^{NaOH/乙醇}$CH2=CH2+HCl;
④为乙烯的加成反应,方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;
⑤为乙醇的消去反应,方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
故答案为:CH3CH2Cl+H2O$→_{△}^{NaOH}$CH3CH2OH+HCl;CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl;CH3CH2Cl$→_{△}^{NaOH/乙醇}$CH2=CH2+HCl;CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质以及反应条件,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.某课外活动小组为探究金属与浓硫酸反应,进行了如下实验.
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:
实验装置如图1所示.(固定装置已略去)
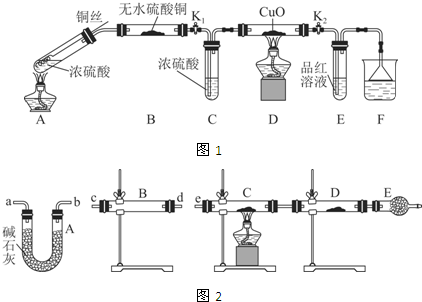
(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)F烧杯中的溶液通常是NaOH溶液(或酸性KMnO4溶液等).
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝.
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(1)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(2)某同学用下列装置(如图2)连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).
(3)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
①无水硫酸铜②固体由白色变成蓝色③SO2中含有水蒸气④C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色⑤SO2中含有氢气.
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:
实验装置如图1所示.(固定装置已略去)

(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)F烧杯中的溶液通常是NaOH溶液(或酸性KMnO4溶液等).
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝.
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(1)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(2)某同学用下列装置(如图2)连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).
(3)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
12.下列说法不正确的是( )
| A. | 用干燥洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH | |
| B. | 实验时受溴腐蚀致伤,先用苯或甘油洗伤口,再用水洗 | |
| C. | 可用重结晶法提纯含少量NaCl的KNO3晶体 | |
| D. | 容量瓶、滴定管上都标有使用温度,容量瓶无“O”刻度,滴定管有“O”刻度,使用前水洗后滴定管还需润洗,而容量瓶不需要润洗 |
9.下列说法不正确的是( )
| A. | 二氯丙烷有三种同分异构体 | |
| B. | 碳酸氢钠可用作食品加工中的无铝发泡剂,快速发酵粉 | |
| C. | 二氧化碳制全降解塑料有助于控制温室效应和白色污染 | |
| D. | 某化合物的分子式为C8H10O,其中能与乙酸发生酯化反应的同分异构体有4种 |
16.下列化学用语表达正确的有( )
①羟基的电子式: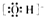
②次氯酸分子的结构式:H-O-Cl
③乙烯的最简式(实验式):CH2=CH2
④含有10个中子的氧原子:188O
⑤铝离子的结构示意图: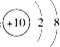
⑥二氧化碳分子的比例模型
①羟基的电子式:
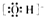
②次氯酸分子的结构式:H-O-Cl
③乙烯的最简式(实验式):CH2=CH2
④含有10个中子的氧原子:188O
⑤铝离子的结构示意图:
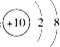
⑥二氧化碳分子的比例模型

| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
6.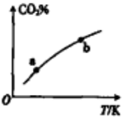 向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)?HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示.下列物理量中,a点大于b点的是 ( )
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)?HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示.下列物理量中,a点大于b点的是 ( )
①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数.
 向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)?HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示.下列物理量中,a点大于b点的是 ( )
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)?HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示.下列物理量中,a点大于b点的是 ( )①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数.
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
10.下列离子方程式书写正确的是( )
| A. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-=3I2+2H2O | |
| B. | 亚硫酸钠溶液与双氧水混合:SO32-+2H2O2=SO42-+2H2O+O2↑ | |
| C. | a mol FeI2溶液中通入2a mol Cl2:2Fe2++4I-+3Cl2=2I2+2Fe3++6C1- | |
| D. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- |
11. 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
注:经检验黑色固体为Ag
①白色沉淀的化学式是Ag2SO4.②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
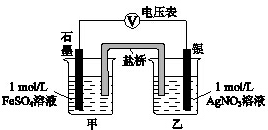
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:
偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
①实验Ⅲ不能(填“能”或“不能”)证明Fe3+氧化了Ag,理由是因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag.
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag=Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3溶液加入到 1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是Ag2SO4.②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:
偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag=Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
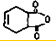 一种生产除虫剂胺菊酯的重要原料,其合成路线如下:
一种生产除虫剂胺菊酯的重要原料,其合成路线如下: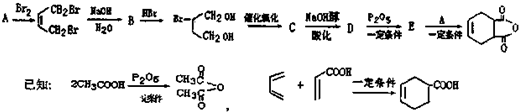
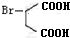 ,A的系统命名为1,3-丁二烯;
,A的系统命名为1,3-丁二烯; ;
;