题目内容
19.工业上电解饱和食盐水制氯气和实验室用MnO2与浓盐酸反应制氯气,相同的原理是( )| A. | 都是将负价的氯转变为零价的氯 | B. | 都是将正价的氯转变为零价的氯 | ||
| C. | 都是复分解反应 | D. | 都是置换反应 |
分析 工业上电解饱和食盐水是利用电解原理,使溶液中氯离子和氢离子分别在两个电极发生氧化反应和还原反应生成氯气、氢气和氢氧化钠;
实验室用MnO2与浓盐酸加热反应制氯气,生成氯气、二氧化锰和水,结合两种制备过程中氯元素的化合价变化分析判断;
解答 解:工业上电解饱和食盐水是利用电解原理,使溶液中氯离子和氢离子分别在两个电极发生氧化反应和还原反应生成氯气、氢气和氢氧化钠,反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
实验室用MnO2与浓盐酸加热反应制氯气,生成氯气、二氧化锰和水,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
A、反应中都是-1价氯元素变化为0价氯元素,氯元素被氧化剂氧化为氯气,是相同的原理,故A正确;
B、反应中都是-1价变化为0价发生的氧化还原反应,故B错误;
C、反应过程中都有元素化合价的变化,属于氧化还原反应,故C错误;
D、置换反应是单质和化合物反应生成另一种单质和另一种化合物,上述两种反应不符合置换反应特征,属于氧化还原反应,故D错误;
故选A.
点评 本题考查了制备氯气的反应原理和化学反应过程分析判断,主要是反应类型分析,氧化还原反应的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列说法正确的是( )
| A. | 电解质与非电解质的本质区别,是在水溶液中或熔融状态下能否电离 | |
| B. | 在水溶液中和熔融状态下都能导电的化合物叫电解质 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都是非电解质 | |
| D. | 常见的强酸、强碱和大部分盐都是电解质,其他化合物都是非电解质 |
7.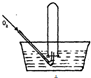 将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
 将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )| A. | 49mL | B. | 28 mL | C. | 30mL | D. | 24.5mL |
14.在化学反应中,会发生变化的是( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 质量数 |
11.在A?B+C反应中,温度每升高10℃,反应速率增大到原来的4倍,现将反应体系的温度由12℃升高到42℃,反应速率增加到原来的( )
| A. | 8倍 | B. | 12倍 | C. | 24倍 | D. | 64倍 |
9.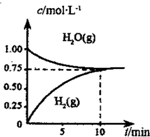 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 达平衡时,CH4(g)的转化率为75% | |
| B. | 0~10min内,v(CO)=0.075mol•L-1•min-1 | |
| C. | 该反应的化学平衡常数K=O.1875 | |
| D. | 当CH4(g)的消耗速率与H2(g)的消耗速率相等时,反应到达平衡 |