题目内容
4.(1)实验室用二氧化锰跟浓盐酸共热反应制氯气.也可用KMnO4跟浓盐酸反应制氯气.KMnO4是常用的氧化剂.在酸性条件下,MnO4-被还原成Mn2+.用高锰酸钾跟浓盐酸在室温下制氯气的化学方程式是2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O.(2)历史上曾用“地康法”制氯气.这一方法是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.这一反应的化学方程式为:4HCl+O2$\frac{\underline{\;CuCl_{2}\;}}{450℃}$2Cl2↑+2H2O.
(3)从氯元素化合价的变化看,以上三种方法的共同点是都属于氧化还原反应,氯元素的化合价从-1升到0价.
(4)比较以上三个反应,可认为氧化剂的氧化能力从强到弱的顺序为:KMnO4>MnO2>O2.
分析 (1)实验室用二氧化锰跟浓盐酸加热反应制取氯气,生成氯化锰、氯气和水,用高锰酸钾跟浓盐酸反应在室温下制氯气,在酸性条件下,MnO4-被还原成Mn2+,依据氧化还原反应电子守恒、电荷守恒、原子守恒配平写出;
(2)用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,生成氯气和水;
(3)反应中都有元素化合价变化,都属于氧化还原反应,反应中氯元素化合价都是从-1价变化为0价;
(4)氧化还原反应中氧化剂的氧化性大于氧化产物.
解答 解:(1)实验室用二氧化锰跟浓盐酸加热反应制取氯气,生成氯化锰、氯气和水,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,用高锰酸钾跟浓盐酸反应在室温下制氯气,在酸性条件下,MnO4-被还原成Mn2+,依据氧化还原反应电子守恒、电荷守恒、原子守恒配平得到化学方程式为:2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O;
故答案为:2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O;
(2)用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,生成氯气和水,配平书写化学方程式为:4HCl+O2$\frac{\underline{\;CuCl_{2}\;}}{450℃}$2Cl2↑+2H2O;
故答案为:4HCl+O2$\frac{\underline{\;CuCl_{2}\;}}{450℃}$2Cl2↑+2H2O;
(3)分析三个反应可知都是氯元素化合价升高生成氯气的反应,所以共同点为:氯元素的化合价从-1升到0价,都属于氧化还原反应,
故答案为:都属于氧化还原反应,氯元素的化合价从-1升到0价;
(4)2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,4HCl+O2 $\frac{\underline{\;CuCl_{2}\;}}{450℃}$2Cl2↑+2H2O;
依据氧化还原反应中氧化剂的氧化性大于氧化产物,高锰酸钾在常温下氧化浓盐酸,二氧化锰在加热条件下氧化浓盐酸,说明高锰酸钾氧化性大于二氧化锰,反应化学方程式分析可知二氧化锰的氧化性大于氯气,氧气的氧化性大于氯气;所以氧化性为:KMnO4>MnO2>O2;
故答案为:KMnO4>MnO2>O2.
点评 本题考查了物质性质和化学方程式、离子方程式书写方法,氧化还原反应规律的应用,题目难度中等.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | 75% | B. | 25% | C. | 50% | D. | 45% |
| A. | 都是将负价的氯转变为零价的氯 | B. | 都是将正价的氯转变为零价的氯 | ||
| C. | 都是复分解反应 | D. | 都是置换反应 |
| A. | 电池的总反应式:Cd+2NiOOH+2H2O$?_{充电}^{放电}$2Ni(OH)2+Cd(OH)2 | |
| B. | 电池充电时,镉元素被还原 | |
| C. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| D. | 电池充电时,电池的负极和电源的正极连接 |
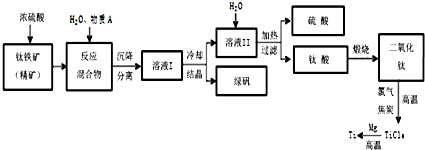
 工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O