题目内容
7.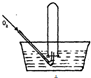 将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )| A. | 49mL | B. | 28 mL | C. | 30mL | D. | 24.5mL |
分析 最后试管中的液面仍在原的位置,说明反应后氧气的体积等于原试管中NO的体积,结合反应4NO+3O2+2H2O=4HNO3计算.
解答 解:通入氧气发生4NO+3O2+2H2O=4HNO3,
如NO过量,发生4NO+3O2+2H2O=4HNO3,则体积不可能与原来相等,应为氧气过量,
则4NO+3O2+2H2O=4HNO3,
V $\frac{3}{4}$V
49-$\frac{3}{4}$V=V,
V=28,
故选B.
点评 本题考查氮的氧化物性质、根据方程式计算的计算等,清楚发生的反应是解题关键,注意利用总反应方程式进行的解答,难度中等.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
18.一下气体因与人体血液中的血红蛋白作用引起中毒的是( )
| A. | NO | B. | CO | C. | NO2 | D. | CO2 |
19.工业上电解饱和食盐水制氯气和实验室用MnO2与浓盐酸反应制氯气,相同的原理是( )
| A. | 都是将负价的氯转变为零价的氯 | B. | 都是将正价的氯转变为零价的氯 | ||
| C. | 都是复分解反应 | D. | 都是置换反应 |