题目内容
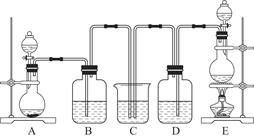
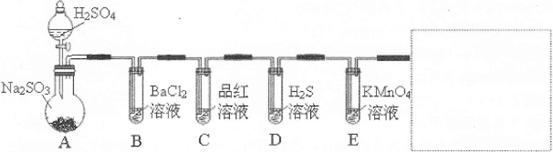
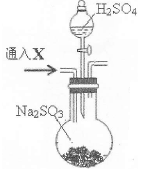
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。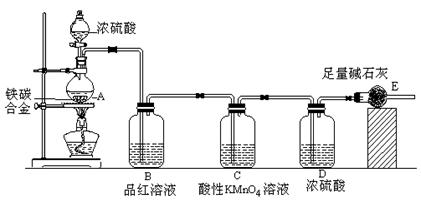
(1)m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是①常温下碳与浓硫酸不反应;② 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 。
(3)B中的现象是: ;
C的作用是: 。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 (写含m、b的表达式)。
⑸反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
A:只含有Fe3+;B:只含有Fe2+;C: 。
验证C的实验方法是
。
(1) 常温下Fe遇浓硫酸发生钝化 (1分)
(2) C + 2H2SO4(浓)  CO2↑ + 2SO2↑ + 2H2O(2分)
CO2↑ + 2SO2↑ + 2H2O(2分)
(3) 品红溶液褪色,或“颜色变浅” (1分) 除尽反应产物中的SO2气体 (1分)
(4)(11m-3b)/11m (2分)
⑸既有Fe3+又有Fe2+ (1分)
取试样少许于试管中,先滴加少量的KSCN溶液,振荡后溶液显红色证明有Fe3+ (1分);再取试样少许于另一支试管中,滴加少量的酸性KMnO4溶液,若浅红色褪去,证明溶液中含有Fe2+(1分)。 (2分,检验Fe3+ 1分,检验Fe2+ 1分)
解析试题分析:(1)依据铁在常温下在浓硫酸中钝化,碳和浓硫酸需要加热反应分析可知,往铁碳合金中加入浓硫酸,未点燃酒精灯前,A、B均无明显现象。
(2)碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,则化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,
CO2↑+2SO2↑+2H2O,
(3)气体中含有二氧化硫,通过品红溶液会褪色,通过高锰酸钾溶液可以除去二氧化硫,避免干扰二氧化碳的测定。
(4)根据CO2+Ca(OH)2=CaCO3↓+H2O,E增重b g,可算出碳的质量有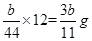 g,则铁的质量分数:
g,则铁的质量分数: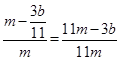
(5)由A、B假设可推出C假设为:既有Fe3+又有Fe2+;可用KSCN检验Fe3+、然后用酸性KMnO4溶液检验Fe2+。
考点:本题考查对实验方案与实验装置的评价、元素化合物性质、化学计算。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。
可选药品:稀硝酸、浓硝酸、浓硫酸、NaOH溶液、蒸馏水
查阅资料:
A.浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
B.氢氧化钠溶液不与NO反应,能与NO2反应2NO2 + 2NaOH = NaNO3 + NaNO2 +H2O
| 实验过程 | 实验现象 |
| I.检验装置的气密性 | |
| II.…… | |
| III.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | ①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无色,通过④后变为红棕色 |
(1)①中发生反应的离子方程式是 。
(2)②中发生反应的化学方程式是 。
(3)装置②~⑤中盛放的药品分别是② 、③ 、④ 、⑤ 。
(4)II的操作是 ,目的是 。
(5)该同学得出结论所依据的实验现象是 。