题目内容
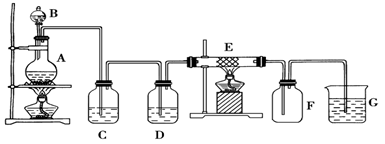
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。
可选药品:稀硝酸、浓硝酸、浓硫酸、NaOH溶液、蒸馏水
查阅资料:
A.浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
B.氢氧化钠溶液不与NO反应,能与NO2反应2NO2 + 2NaOH = NaNO3 + NaNO2 +H2O
| 实验过程 | 实验现象 |
| I.检验装置的气密性 | |
| II.…… | |
| III.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | ①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无色,通过④后变为红棕色 |
(1)①中发生反应的离子方程式是 。
(2)②中发生反应的化学方程式是 。
(3)装置②~⑤中盛放的药品分别是② 、③ 、④ 、⑤ 。
(4)II的操作是 ,目的是 。
(5)该同学得出结论所依据的实验现象是 。
(1)Cu+4H++2NO3—== Cu2++2NO2↑+2H2O
(2)3NO2+ H2O == 2HNO3+ NO
(3)蒸馏水、稀硝酸、浓硝酸、氢氧化钠溶液
(4)打开弹簧夹,通一段时间N2,关闭弹簧夹 赶净装置中的空气(或氧气)
(5)③中液面上方为无色,④中液面上方变为红棕色
解析试题分析:(1)在①中Cu与浓硝酸发生反应:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O离子方程式是Cu+4H++2NO3—== Cu2++2NO2↑+2H2O.(2)②中发生反应的化学方程式是3NO2+ H2O == 2HNO3+ NO。(3)装置②~⑤中盛放的药品分别是②蒸馏水、③稀硝酸、④浓硝酸、⑤氢氧化钠溶液。(4)检验装置的气密性后进行的II的操作是打开弹簧夹,通一段时间N2,关闭弹簧夹,目的是赶净装置中的空气(或氧气)使整个系统处于惰性环境中,防止空气中的氧气把反应产生的NO氧化而影响实验结果的判断。(5)①中发生反应:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O,②中发生反应3NO2+ H2O == 2HNO3+ NO,③不反应,④中发生反应NO+2HNO3(浓)= 3NO2↑+H2O,⑤中发生反应2NO2 + 2NaOH = NaNO3 + NaNO2 +H2O.因此该同学得出结论所依据的实验现象是③中液面上方为无色,④中液面上方变为红棕色。
考点:考查浓、稀硝酸氧化性的相对强弱及离子方程式的书写、试剂使用的先后顺序等的知识。

 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发现的有关问题。
Ⅰ.探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的浓硫酸、稀硫酸、浓硝酸、稀硝酸,实验结果记录如下表:
| | 酸 | 实验结果 |
| a | 浓硫酸 | 加热后发生反应,产生无色刺激性气体 |
| b | 稀硫酸 | 加热也不发生反应 |
| c | 浓硝酸 | 不加热即发生反应,产生红棕色气体 |
| d | 稀硝酸 | 微热发生反应,产生无色气体 |
①由上表中实验结果,四种酸的氧化性由强到弱的顺序是 。
②由上表可知,铜与稀硫酸在加热条件下不反应,但若同时通入O2,铜片能逐渐溶解,溶液变为蓝色。写出该反应的化学方程式:
(2)先将铜与浓硫酸反应产生的气体X持续通入如图所示装置中,一段时间后再将铜与浓硝酸产生的气体Y也持续通入该装置中,则整个过程中可观察到的现象包括 (填字母)。

A.通入X气体后产生白色沉淀
B.通入X气体后溶液无明显现象
C.通入Y气体后产生沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是 (填字母)。
A.硝酸的酸性比硫酸强
B.H2SO3的酸性比盐酸强
C.HNO3能氧化H2SO3(或SO2)
D.BaSO4既不溶于水也不溶于HNO3溶液
Ⅱ.如图是某同学探究铜与稀硝酸反应的还原产物的实验装置图,请回答下列问题:

(1)写出铜与稀硝酸反应的离子方程式: 。
(2)已知装置气密性良好,请简述利用该装置证明铜与稀硝酸反应生成的气体产物是NO的操作过程:
工业上常用铁质容器盛装冷浓硫酸。某兴趣小组的同学发现:将一定量的生铁与浓硫酸加热时,观察到固体完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.10 mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中肯定含有 气体。
【实验探究】
| | 实验操作 | 预期现象 | 结 论 |
| 验证猜想Ⅰ | 步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液中 | | |
| 步骤②: | | 含有Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 | | 含有两种或以上气体 |

【问题讨论】
(1)有同学提出:若另外选用KSCN溶液,则仅利用KSCN和新制氯水两种溶液即可完成猜想Ⅰ的所有探究,试问是否可行,并说明原因: 。
(2)有同学提出:试管中气体可能是H2和Q气体,为此重新设计了实验装置如下图(图中夹持仪器省略)。

①Q产生的原因是 (用化学方程式表示)。
②为确认Q的存在,则M中盛放的试剂为 ,并将装置M添加于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
③装置图中D、E、F组合的作用是 。



 [
[