题目内容
12. 二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247KJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205KJ•mol-1
则反应CO2(g)+4H2(g)?CH2(g)+2H2O(g)的△H3=-165kJ•mol-1
(2)在一定压强下,在某恒定密闭容器中充入H2和CO2发生反应:
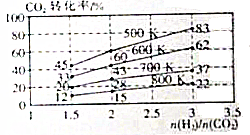
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,
H2的转化率为40%若达到平衡后,H2的浓度为a mol•L-1,则达到平衡时CH3CH2OH的浓度为0.1amol•L-1.
(3)CO2和H2在一定条件下可合成二甲醛:2CO2(g)+6H2(g)?CH3OH(g)+3H2O(g)△H.在一定压强下,将2.5mol H2与a mol CO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据都如表:
①x,y的大小关系为B
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z,ω时,达到平衡的时间前者长
D.转化率分别为y,ω时,平衡常数不同.
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式中的反应热;
(2)由图可知其起始投料比为1.25,温度由600→500,二氧化碳的转化率升高,所以平衡正向移动;
(3)因为700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,二氧化碳的转化率为20%,求氢气的变化量,从而求出转化率;
(4)①由(2)可知温度升高,平衡逆向移动,二氧化碳转化率变小,而其起始投料比减小,实际上增加二氧化碳的量,二氧化碳的转化率减小;
②A.降低温度平衡正向移动,该反应的△H<0,正反应是气体物质的量减少的方向,所以△S<0;
B.降低温度平衡正向移动,所以正反应是放热反应,温度升高而平衡常数随减小;
C.温度越高达平衡时间越短;
D.平衡常数是温度的函数.
解答 解:(1)令①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1,②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ•mol-1
②-①×2得到CO2(g)+4H2(g)═CH4(g)+2H2O(g)△H=-165kJ•mol-1 ;故答案为:-165kJ•mol-1;
(2)由图可知其起始投料比为1.25,温度由600→500,二氧化碳的转化率升高,所以平衡正向移动,故答案为:正;
(3)2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)
初起量:4 6 0 0
变化量:0.8 2.4 0.4 3.2
所以H2的转化率为$\frac{2.4}{6}$×100%=40%,平衡时H2的浓度为a mol•L-1,则达到平衡时CH3CH2OH的浓度为$\frac{0.4}{6-2.4}×a$=0.1amol•L-1,故答案为:40%;0.1amol•L-1;(4)①由(2)可知温度升高,平衡逆向移动,二氧化碳转化率变小,而其起始投料比减小,实际上增加二氧化碳的量,二氧化碳的转化率减小,综上所述,x>y,故选:B;
②A.降低温度平衡正向移动,该反应的△H<0,正反应是气体物质的量减少的方向,所以△S<0,故正确;
B.降低温度平衡正向移动,所以正反应是放热反应,温度升高而平衡常数随减小,故正确;
C.w对应的温度高,所以达平衡时间越短,即达到平衡的时间z长,故正确;
D.两者温度相同,所以平衡常数相同,故错误;
故选ABC.
点评 本题考查反应热计算、平衡常数及影响因素、反应速率与平衡移动影响因素、化学平衡计算等侧重考查学生对图象的分析与平衡移动的理解,难中等大注意基础知识的理解掌握.

 |  |  |  |
| ① | ② | ③ | ④ |
| A. | 装置①可用于模拟氯碱工业生产氯气 | |
| B. | 装置②的原理可用于潮汐能发电站钢阀门的保护 | |
| C. | 装置③可用于食盐水的蒸发结晶 | |
| D. | 装置④可用于二氧化锰与浓盐酸反应制取氯气 |
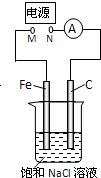
| A. | 去掉电源,将M、N用导线直接相连,则Fe棒上产生气泡 | |
| B. | M接电源负极,N接电源正极,Fe棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| C. | M接电源正极,N接电源负极,将石墨棒换成Cu棒,电解质溶液换成CuSO4溶液,则可实现在铁棒上镀铜 | |
| D. | 去掉电源,将M、N用导线直接相连,烧杯中的溶液换成经酸化的3% NaCl溶液,向Fe电极区滴入2滴K3[Fe(CN)6]溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
| A. | 纳米碳酸钙材料能够产生丁达尔效应 | |
| B. | NOx、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 纯碱可用于制造玻璃,也可用于除去物品表面的油污 | |
| D. | 糖类、油脂、蛋白质均能发生水解反应 |
| A. | 2种 | B. | 3种 | C. | 5种 | D. | 6种 |
| A. | 苯与溴水混合可发生加成反应 | |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 煤的干馏可以得到苯、甲苯和二甲苯 | |
| D. |  命名为2-甲基-3-戊烯 命名为2-甲基-3-戊烯 |
| A. | 含大量 H+的溶液中:CrO42-、Cl-、N03-、Na+ | |
| B. | 含大量 A102-的溶液中:Na+、K+、NO3-、HCO3- | |
| C. | 含大量 Al3+的溶液中:K+、Na+、NO3-、Cl0- | |
| D. | 含大量 CH3COO- 的溶液中:NH4+、Cl-、F-、K+ |