题目内容
KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,有关该反应,说法不正确的是:( )
| A.被氧化的元素和被还原的元素的质量之比5:1 |
| B.Cl2既是氧化产物,又是还原产物 |
| C.盐酸既体现酸性,又体现酸性还原性 |
| D.转移5mol电子时,产生67.2L的Cl2 |
D
试题分析:在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,KClO3中的Cl得到电子,被还原变为Cl2,每摩尔的Cl得到5mol的电子,HCl中的Cl失去电子,也变为Cl2,每摩尔的Cl失去1mol的电子。A.由于在氧化还原反应中电子得失数目相等。因此被氧化的元素和被还原的元素的质量之比5:1。正确。B.Cl2既是氧化产物,又是还原产物。正确。C.在该反应中6mold HCl促进反应,有1mol的起酸的作用,有5mol的作还原剂。故在该反应中盐酸既体现酸性,又体现酸性还原性。正确。 D.转移5mol电子时,产生3mold的Cl2。在标准状况下其体积为67.2L。却条件,体积大小无意义。错误。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
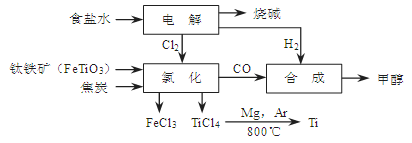
 CH3OH(g)。
CH3OH(g)。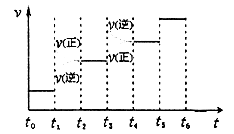


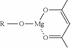 ,它可发生如下反应:
,它可发生如下反应: