题目内容
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能 级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最 小的元素;E的最高价氧化物的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余 能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素A、B、C的第一电离能由小到大的是_______用元素符号表示)。
(2)E的最高价含氧酸中E的杂化方式为_______。
(3)F原子的外围电子排布式为_______,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。

(4)DE,GE两种晶体,都属于离子晶体,但配位数不同,其原因是_______
(5)已知DE晶体的晶胞如下图所示
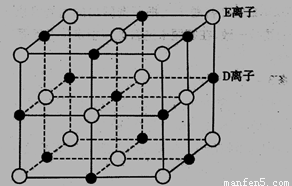
若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小 立方体”中心各放置一个A原子,且这4个“小立方体”不相邻。位于“小立方体”中的A原 子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A — A键的键长 为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_____个A原子,该晶体的密度是_____ g/cm
(15分)
(1) C< O< N (2分)
(2) sp3杂化(2分)
(3) 3d104s1 (2分)
(4)
正负离子的半径比不同(2分)(5)8(2分)  (3分)
(3分)
【解析】
试题分析:(1)同一周期内主族元素的第一电离能从左到右在总体增大的趋势中有些曲折.当外围电子在能量相等的轨道上形成全空、半满或全满结构时,原子的能量较低,元素的第一电离能较大.由于N元素的2p能级3个轨道处于半满,所以第一电离能较O元素的高,所以 A、B、C三种元素原子的第一电离能由大到小的顺序是N>O>C, (2) 由价层电子对互斥理论可以推出中心原子采用SP3杂化方式(3)金属铜采用面心立方最密堆积(4)中心离子半径大小决定了离子的外围空间,阴离子相同时,阳离子半径越大,配位数越大。(5)晶胞中体心一个A原子,棱上12个,相当于3个A原子,4个“小 立方体”中心各放置一个A原子,加在一起,可得一个晶胞中有8个A原子
把整个晶胞分成四个体积相等的小正方体,每个小正方体的体对角线是两倍键长,即为2a;可推出整个晶胞的边长 ,立方就可以算出体积。然后8×12再除以NA(阿伏伽德罗常数)就是晶胞的质量,最后拿质量除以体积得到答案。
,立方就可以算出体积。然后8×12再除以NA(阿伏伽德罗常数)就是晶胞的质量,最后拿质量除以体积得到答案。
考点:位置结构性质的相互关系应用;原子核外电子排布;晶体的类型与物质熔点的关系;晶胞的计算;原子轨道杂化方式及杂化类型判断

 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.