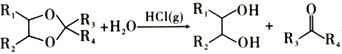题目内容
【题目】常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是

A. 当V( NaOH )= 20mL时,pH<7
B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-)
【答案】D
【解析】A. 当V( NaOH )= 20mL时,H2A恰好与NaOH反应生成HA-,由图可知,此时溶液中n(H2A)>n(A2-),说明HA-的水解程度大于其电离程度,故溶液显碱性,pH>7,A不正确;B. 当V(NaOH)= 20mL时,结合图中信息可知,溶液中离子浓度大小关系为c(Na+)> c(HA-)> c(OH-)> c(H+)>c(A2-),B不正确;C. 当V(NaOH)= 10mL时,由物料守恒可知,2c(Na+)= c(HA-)+c(A2-)+c(H2A),C不正确;D. 当V(NaOH)= 30mL时,由电荷守恒c(H+)+c(Na+)= c(HA-)+2c(A2-)+ c(OH-)和物料守恒2c(Na+)= 3[c(HA-)+c(A2-)+c(H2A)],可以求得质子守恒式:2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-),D正确。本题选D。

【题目】中学教材显示“浓硫酸具有吸水性、脱水性、强氧化性,能使铁钝化”。某学习小组对“具有该四个特性的浓硫酸的浓度范围”进行了以下实验探究。
(1)配制不同浓度的硫酸用18.4 mol/L的浓硫酸配制不同浓度的硫酸。下列操作正确的是_____。
A. 量取浓硫酸 B.
量取浓硫酸 B.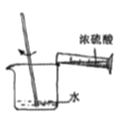 稀释浓硫酸 C.
稀释浓硫酸 C.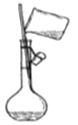 转移入容量瓶 D.
转移入容量瓶 D.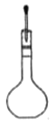 定容
定容
(2)浓硫酸的吸水性、脱水性、纯化与浓度的关系
①浓硫酸的吸水性:各取0.5g胆矾颗粒于试管中,分别加入3mL不同浓度的硫酸。
②浓硫酸的脱水性:各取一根木柴梗于试臂中,分别加入1mL不同浓度的硫酸。
③浓硫酸的钝化:各取约1cm经过砂纸打磨过的铁丝,再向试管中加入3mL不同浓度的硫酸。
实验结果见下表:
实验 | c(H2SO4)/mol/L | 18.4 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 1-5 |
① | 胆矾颜色变化 | 蓝一白 | 蓝一白 | 蓝一白 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 |
② | 木柴梗颜色变化 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 不变 |
③ | 铁丝表面气泡 | 无 | 无 | 有 | 有 | 有 | 有 | 有 | 有 | 有 |
结合表格数据回答下列问题:
用化学方程式表示胆矾由“蓝一白”的原因:_______;当硫酸的浓度≥______mol/L时即具有脱水性。
(3)浓硫酸的强氧化性与浓度的关系
在试管中分别加入1小块铜片,再向试管中分别加入2mL 不同浓度的硫酸,用下图所示的装置进行实验。(夹持仪器略去)
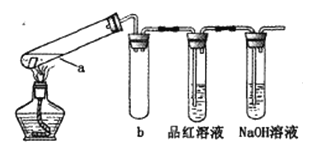
①b装置的作用是________
②本实验中证明浓硫酸具有强氧化性的现象是_________、________。
③试管a中加热时产生黑色的固体,经检验该黑色固体中含有Cu2S。写出生成该物质的化学方程式____.
④经过实验发现:c(H2SO4)≥ 6mol/L时,硫酸与铜在加热反应时即可表现强氧化性。有同学预测,铜片与5mol/L的硫酸在长时间持续加热时,也会发生反应。该预测的理由是_______.
(4)综合该小组同学的探究结果,中学教材中同时具有“吸水性、脱水性、使铁钝化、强氧化性”的浓硫酸的浓度范围为________mol/L。