题目内容
【题目】中学教材显示“浓硫酸具有吸水性、脱水性、强氧化性,能使铁钝化”。某学习小组对“具有该四个特性的浓硫酸的浓度范围”进行了以下实验探究。
(1)配制不同浓度的硫酸用18.4 mol/L的浓硫酸配制不同浓度的硫酸。下列操作正确的是_____。
A.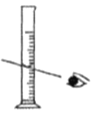 量取浓硫酸 B.
量取浓硫酸 B.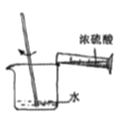 稀释浓硫酸 C.
稀释浓硫酸 C. 转移入容量瓶 D.
转移入容量瓶 D. 定容
定容
(2)浓硫酸的吸水性、脱水性、纯化与浓度的关系
①浓硫酸的吸水性:各取0.5g胆矾颗粒于试管中,分别加入3mL不同浓度的硫酸。
②浓硫酸的脱水性:各取一根木柴梗于试臂中,分别加入1mL不同浓度的硫酸。
③浓硫酸的钝化:各取约1cm经过砂纸打磨过的铁丝,再向试管中加入3mL不同浓度的硫酸。
实验结果见下表:
实验 | c(H2SO4)/mol/L | 18.4 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 1-5 |
① | 胆矾颜色变化 | 蓝一白 | 蓝一白 | 蓝一白 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 |
② | 木柴梗颜色变化 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 不变 |
③ | 铁丝表面气泡 | 无 | 无 | 有 | 有 | 有 | 有 | 有 | 有 | 有 |
结合表格数据回答下列问题:
用化学方程式表示胆矾由“蓝一白”的原因:_______;当硫酸的浓度≥______mol/L时即具有脱水性。
(3)浓硫酸的强氧化性与浓度的关系
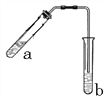
在试管中分别加入1小块铜片,再向试管中分别加入2mL 不同浓度的硫酸,用下图所示的装置进行实验。(夹持仪器略去)
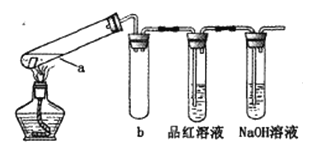
①b装置的作用是________
②本实验中证明浓硫酸具有强氧化性的现象是_________、________。
③试管a中加热时产生黑色的固体,经检验该黑色固体中含有Cu2S。写出生成该物质的化学方程式____.
④经过实验发现:c(H2SO4)≥ 6mol/L时,硫酸与铜在加热反应时即可表现强氧化性。有同学预测,铜片与5mol/L的硫酸在长时间持续加热时,也会发生反应。该预测的理由是_______.
(4)综合该小组同学的探究结果,中学教材中同时具有“吸水性、脱水性、使铁钝化、强氧化性”的浓硫酸的浓度范围为________mol/L。
【答案】 B C CuSO45H2O=CuSO4 + 5H2 O 6 安全瓶(防止液体倒吸入试管a) 铜片溶解、表面产生气泡 品红溶液退色 5Cu+4H2SO4(浓)![]() Cu2S↓+3CuSO4+4H2O 长时间加热时,水分蒸发,使硫酸浓度增大 c(H2SO4) ≥12
Cu2S↓+3CuSO4+4H2O 长时间加热时,水分蒸发,使硫酸浓度增大 c(H2SO4) ≥12
【解析】(1)用18.4 mol/L的浓硫酸配制不同浓度的硫酸。A、量取浓硫酸,视线应平视,错误;B、稀释浓硫酸应酸入水,正确;C、转移硫酸用玻璃棒引流,正确;D、定容时胶头滴管不能伸入容量瓶中,错误。正确操作为B C。
(2)硫酸铜中结晶水被浓硫酸吸收后,晶体由蓝色变为白色,CuSO45H2O=CuSO4 + 5H2 O; 根据图表信息可知,当硫酸的浓度≥6mol/L时即具有脱水性;正确答案:CuSO45H2O=CuSO4 + 5H2 O;6。
(3)①b装置的作用是防止液体倒吸入试管a,使试管炸裂,正确答案:安全瓶(防止液体倒吸入试管a)。
②铜和浓硫酸加热反应,铜片溶解、表面产生气泡, 产生的气体能够使品红溶液褪色, 浓硫酸被还原为二氧化硫气体,体现了浓硫酸具有强氧化性;正确答案:铜片溶解、表面产生气泡 ; 品红溶液褪色。
③浓硫酸与铜加热反应生成硫化亚铜、硫酸铜和水,化学方程式5Cu+4H2SO4(浓)![]() Cu2S↓+3CuSO4+4H2O;正确答案:5Cu+4H2SO4(浓)
Cu2S↓+3CuSO4+4H2O;正确答案:5Cu+4H2SO4(浓)![]() Cu2S↓+3CuSO4+4H2O。
Cu2S↓+3CuSO4+4H2O。
④铜片与5mol/L的硫酸在长时间持续加热时,水分蒸发,使硫酸浓度增大,当浓度达到c(H2SO4)≥ 6mol/L时,硫酸与铜在加热反应时即可表现强氧化性;正确答案:长时间加热时,水分蒸发,使硫酸浓度增大。
(4)结合表中相关信息可知中学教材中同时具有“吸水性、脱水性、使铁钝化、强氧化性”的浓硫酸的浓度范围为) c(H2SO4) ≥12mol/L;正确答案:c(H2SO4) ≥12。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案