题目内容
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,极少量的Na+以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。

(1)步骤1的主要操作名称是_____,该操作用到的玻璃仪器是_____
A.烧杯 B.漏斗 C.酒精灯 D.玻璃棒
(2)固体X是_____(填化学式),溶液Y是_____(填化学式)
(3)步骤2中发生反应的离子方程式为 _____ 。
(4)将回收的铜和一定浓度的稀硫酸混合后在加热的情况下通入氧气,发生反应:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O中,氧化剂是________,还原剂是_______。用单线桥法标出上述反应的电子得失:______________________。
2CuSO4+2H2O中,氧化剂是________,还原剂是_______。用单线桥法标出上述反应的电子得失:______________________。
(5)步骤4中涉及的操作是:蒸发浓缩、___________、过滤、洗涤、干燥。
【答案】过滤 ABD Fe H2SO4 Fe+Cu2+===Fe2++Cu O2 Cu 2Cu+2H2SO4+O2![]() 2CuSO4+2H2O 冷却结晶
2CuSO4+2H2O 冷却结晶
【解析】
工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+以及部分污泥,首先通过步骤1进行过滤除去污泥,在步骤2中加入过量的Fe,发生反应为Fe+Cu2+═Cu+2Fe2+,过量的Fe用稀硫酸除去,发生反应为Fe+H2SO4═FeSO4+H2↑,最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO47H2O晶体。
(1)步骤1、步骤2、步骤3都为过滤操作,需要的玻璃仪器有烧杯、玻璃棒、普通漏斗,故答案为:ABD;
(2)步骤2中加入过量的Fe,发生反应Fe+Cu2+═Cu+2Fe2+,步骤3中过量的Fe用稀硫酸除去,发生反应为Fe+H2SO4═FeSO4+H2↑,固体X是Fe,溶液Y是稀硫酸,故答案为:Fe;稀硫酸;
(3)步骤2中加入过量的Fe,发生反应Fe+Cu2+═Cu+2Fe2+,故答案为:Fe+Cu2+═Cu+2Fe2+;
(4)2Cu+2H2SO4+O2![]() 2CuSO4+2H2O反应中,O2中O元素化合价降低,做氧化剂,Cu单质中Cu元素化合价升高,做氧化剂,故答案为:O2;铜;单线桥略;
2CuSO4+2H2O反应中,O2中O元素化合价降低,做氧化剂,Cu单质中Cu元素化合价升高,做氧化剂,故答案为:O2;铜;单线桥略;
(5)最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO47H2O晶体,故答案为:冷却结晶。

【题目】实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
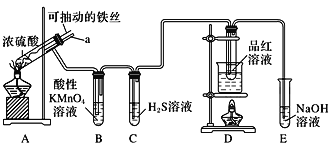
A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性 |
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+ |
C.装置D中品红溶液褪色可以验证SO2的漂白性 |
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 |