题目内容
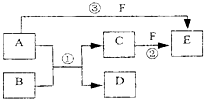 A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色;反应③中有水生成,反应②需要放电才能发生,A和 D相遇有白烟生成.
(1)反应③的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;
| ||
| △ |
(2)反应①中每生成1mol C,转移的电子数为
3.612×1024
3.612×1024
;(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈
酸
酸
性(填“酸”“碱”或“中”),该水溶液中存在着如下关系,用粒子浓度符号填写:①c(H+)+
c(NH4+)
c(NH4+)
=c(OH-)+c(Cl-)
c(Cl-)
;②c(H+)=c(OH-)+
c(NH3?H2O)
c(NH3?H2O)
.(4)元素x与组成B的元素同周期,x的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
;②X、空气、海水可以组成新型海水标志灯的电池.该种灯以海水为电解质溶液,靠空气中的氧气使X不断氧化而源源不断产生电流,只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍.则该新型电池的正极的电极反应式为
O2+H2O+4e-=4OH-
O2+H2O+4e-=4OH-
;原电池的总反应方程式为4Al+3O2+6H2O=4Al(OH)3
4Al+3O2+6H2O=4Al(OH)3
.分析:B为黄绿色,应为Cl2,A和D相遇有白烟生成,根据反应转化关系可知A为NH3,D为HCl,反应②需要放电才能发生,说明C为N2,F为O2,则E为NO,结合题目要求和物质的性质可解答该题.
解答:解:B为黄绿色,应为Cl2,A和D相遇有白烟生成,根据反应转化关系可知A为NH3,D为HCl,反应②需要放电才能发生,说明C为N2,F为O2,则E为NO,则
(1)反应③为NH3的催化氧化反应,方程式为4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(2)反应①中每生成1molC,即1molN2,转移的电子数目为2×3×NA=3.612×1024,故答案为:3.612×1024;
(3)A为NH3,D为HCl,反应生成NH4Cl,为强酸弱碱盐,溶液呈酸性,溶液中存在电荷守恒,
则有c(H+)+c(NH4+)=c(OH-)+c(Cl-),溶液中存在质子守恒,则有c(H+)=c(OH-)+c(NH3?H2O),
故答案为:酸,①c(NH4+);c(Cl-);②c(NH3?H2O);
(4)①元素x与组成B的元素同周期,x的单质既可与酸反应也可与碱反应且都生成H2,x为Al,可与碱反应生成氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
②海水、铝、空气电池中正极为氧气得到电子的反应,方程式为O2+H2O+4e-=4OH-,负极为4Al+6H2O-12e-=4Al(OH)3,正负极反应相加可得总反应方程式为4Al+3O2+6H2O=4Al(OH)3,
故答案为:O2+H2O+4e-=4OH-;4Al+3O2+6H2O=4Al(OH)3.
(1)反应③为NH3的催化氧化反应,方程式为4NH3+5O2
| ||
| △ |
| ||
| △ |
(2)反应①中每生成1molC,即1molN2,转移的电子数目为2×3×NA=3.612×1024,故答案为:3.612×1024;
(3)A为NH3,D为HCl,反应生成NH4Cl,为强酸弱碱盐,溶液呈酸性,溶液中存在电荷守恒,
则有c(H+)+c(NH4+)=c(OH-)+c(Cl-),溶液中存在质子守恒,则有c(H+)=c(OH-)+c(NH3?H2O),
故答案为:酸,①c(NH4+);c(Cl-);②c(NH3?H2O);
(4)①元素x与组成B的元素同周期,x的单质既可与酸反应也可与碱反应且都生成H2,x为Al,可与碱反应生成氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
②海水、铝、空气电池中正极为氧气得到电子的反应,方程式为O2+H2O+4e-=4OH-,负极为4Al+6H2O-12e-=4Al(OH)3,正负极反应相加可得总反应方程式为4Al+3O2+6H2O=4Al(OH)3,
故答案为:O2+H2O+4e-=4OH-;4Al+3O2+6H2O=4Al(OH)3.
点评:本题考查无机物的推断,题目难度中等,题目通过不同物质之间的反应对图示中的反应形式进行了考查,同时考查了反应热和电化学的有关问题,是个综合性较强的题目.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.