��Ŀ����
����Ŀ��ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ���ֵ�����⡣��֪��CO(g)+H2O(g)H2(g)+CO2(g)ƽ�ⳣ�����¶ȵı仯���±���
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
�Իش��������⣺
��1����������Ӧ��________��Ӧ (��������������������)��
��2�����������ĸı��ܼӿ��䷴Ӧ���ʵ���_______(ѡ�����)��
�������¶ȣ��ڱ���������䣬ֻ����CO���������۱���������䣬����Neʹ��ϵѹǿ���ܱ���ѹǿ���䣬����Neʹ�������������
��3����һ�ݻ�Ϊ2L���ܱ������ڣ�����0.2molCO��0.4molH2��������ӦCO(g)+2H2(g) CH3OH(g)��CO��ƽ��ת�������¶ȣ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
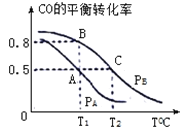
��A��B�����Ӧ��ѹǿ��С��ϵ��PA________PB��(����>������<������=��)
��A��B��C�����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵ�� ____________��
����P1ѹǿ��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=___________��
��4��T1�桢1L���ܱ������ڷ���������Ӧ�����ijʱ�̸����ʵ����ʵ������£�CO��0.1mol H2��0.2mol CH3OH��0.2mol����ʱv�� ____ v��(�� >��< �� =)��
���𰸡����� �٢� < KA=KB>KC 100 >
��������
(1)�ɱ���֪���¶�Խ�ߣ�ƽ�ⳣ��ԽС����Ӧ���г̶�ԽС��˵�������¶ȣ�ƽ�����淴Ӧ�ƶ����ݴ˷����жϣ�
(2)����Ӱ�컯ѧ��Ӧ���ʵ����ط����жϣ�
(3)�ٷ�ӦCO(g)+2H2(g)CH3OH(g)�������������С�ķ�Ӧ����ѹ��Ӧ��ת��������
��ƽ�ⳣ��ֻ���¶�Ӱ�죬��ͼ���������¶�����COת���ʽ��ͣ�˵������Ӧ���ȣ�
��P1ѹǿ��T1��CʱCO��ת����Ϊ0.5����������ʽ������ƽ�ⳣ����
(4)�����ʱŨ���̺�ƽ�ⳣ���Ƚ��ж�ƽ����еķ���
(1)�ɱ���֪���¶�Խ�ߣ�ƽ�ⳣ��ԽС����Ӧ���г̶�ԽС��˵�������¶ȣ�ƽ�����淴Ӧ�ƶ������淴ӦΪ���ȷ�Ӧ��������ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
(2)�������¶ȣ���Ӧ���ʼӿ죬�ʢ�ѡ���ڱ���������䣬ֻ����CO��������CO��Ũ������Ӧ���ʼӿ죬�ʢ�ѡ���۱���������䣬����Neʹ��ϵѹǿ������ֵ�Ũ�Ȳ��䣬��Ӧ���ʲ��䣬�ʢ۲�ѡ���ܱ���ѹǿ���䣬����Neʹ���������������ֵ�Ũ�ȱ�С����Ӧ���ʼ������ʢܲ�ѡ���ʴ�Ϊ���٢ڣ�
(3)�ٷ�ӦCO(g)+2H2(g)CH3OH(g)�������������С�ķ�Ӧ������ѹǿ��ƽ�������ƶ�����Ӧ���ת������������PA��PB���ʴ�Ϊ������
�ھ�ͼ���������¶�����COת���ʽ��ͣ�˵������Ӧ���ȣ������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С������KA=KB��KC���ʴ�Ϊ��KA=KB��KC��
��P1ѹǿ��T1��CʱCO��ת����Ϊ0.5��
CO(g)+2H2(g)CH3OH(g)
��Ӧǰ(mol/L) ��0.10.20
ת����(mol/L)��0.050.10.05
ƽ��ʱ(mol/L)��0.05 0.1 0.05
��ѧƽ�ⳣ��K=![]() =100���ʴ�Ϊ��100��
=100���ʴ�Ϊ��100��
(4)T1��C��1L���ܱ������ڷ���������Ӧ�����ijʱ�̸����ʵ����ʵ������£�CO��0.1mol H2��0.2mol CH3OH��0.2mol����ʱ��Ӧ��Ũ����Qc=![]() =50��K=100����ʱv����v�����ʴ�Ϊ������
=50��K=100����ʱv����v�����ʴ�Ϊ������

 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д� ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�����Ŀ��һ����̼��������̼�����þ���ʮ����Ҫ�����壬��ѧ��������¼������룺
��.������̼�������ڴ��������¿���ȡ��̼ϩ������һ�����ܱ������зֱ�Ͷ��1molCO2��3molH2��������Ӧ��2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ��H���ڲ�ͬ�¶��£��ô��м������ƽ��ʱH2�����ʵ����仯��ϵ��ͼ��ʾ��
C2H4(g)+4H2O(g) ��H���ڲ�ͬ�¶��£��ô��м������ƽ��ʱH2�����ʵ����仯��ϵ��ͼ��ʾ��

��1����H____________ (����>����<����������ȷ����)0��
��2������������ϵ���������������Խ��ͼʾ�ƶ����ȶ��ԣ�C2H4_______(����>�� ��<����������ȷ����)H2O��
��.�״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ | ƽ�� ���� | �¶��� | |
500 | 800 | ||
��2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
��H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
��3H2(g)+CO2(g) | K3 | ||
��1��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ(P)�Ĺ�ϵ��������ͼ��ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A)_____________K(B)�������������������������������ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3=_______����K1��K2��ʾ����

��2����3 L�ݻ��ɱ���ܱ������з�����Ӧ�ڣ���֪
����������Ϊ������ʱ���ı��������_____________________��
��3��һ�ּ״�ȼ�ϵ�أ�ʹ�õĵ������Һ��2mol��L��1��KOH��Һ��

��д������(ͨ��)b����һ���ĵ缫��Ӧʽ_________________��ÿ����6.4g�״�ת�Ƶĵ�����Ϊ_______________��
��4��һ�������¼״���һ����̼��Ӧ���Ժϳ����ᡣͨ��״���£���a mol/L�Ĵ�����b mol/LBa(OH)2��Һ�������Ϻ���Һ�У�2c(Ba2��)= c(CH3COO-)���ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��KaΪ________________��