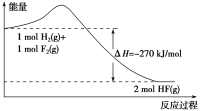
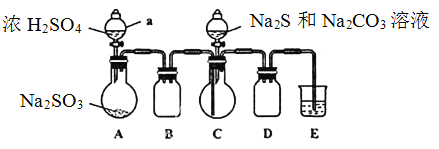
题目内容
【题目】某同学设计了如图实验装置探究硝酸的性质,根据图示判断下列结论不正确的是( )
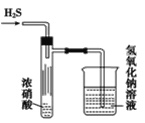
A.试管内壁上的“黄霜”的成分是硫
B.该实验既说明了浓硝酸具有氧化性,又说明了浓硝酸具有挥发性
C.烧杯内氢氧化钠溶液的作用是除去尾气,防止尾气毒害
D.试管中浓硝酸可以用浓盐酸代替
【答案】D
【解析】
A.硫化氢与浓硝酸发生氧化还原生成单质硫,所以试管内壁上“黄霜”的成分是硫,故A正确;
B.试管内壁上有黄霜生成说明硝酸有氧化性和挥发性,所以浓硝酸既有氧化性,又有挥发性,故B正确;
C.硫化氢与硝酸发生氧化还原反应生成氮的氧化物,对环璄造成染污染,所以烧杯内的NaOH溶液的作用是除去尾气,故C正确;
D.浓盐酸无强氧化性,不能代替浓硝酸完成该实验,故D错误;
故答案选D。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案【题目】煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。已知:CO(g)+H2O(g)H2(g)+CO2(g)平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
试回答下列问题:
(1)上述正向反应是________反应 (填“放热”或“吸热”);
(2)下列条件的改变能加快其反应速率的是_______(选填序号);
①升高温度;②保持体积不变,只增加CO的质量;③保持体积不变,充入Ne使体系压强增大;④保持压强不变,充入Ne使容器的体积增大
(3)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2,发生反应CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度,压强的关系如下图所示:
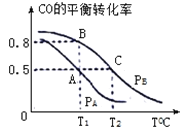
①A、B两点对应的压强大小关系是PA________PB;(填“>”,“<”,“=”)
②A、B、C三点的平衡常数KA、KB、KC的大小关系是 ____________;
③在P1压强、T1℃时,该反应的平衡常数K=___________;
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正 ____ v逆(填 >、< 或 =)。