题目内容
某同学按右图所示的装置进行实验,A、B为两种常见金属,它们的硫酸盐可溶于水。当K闭合时,在交换膜处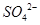 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是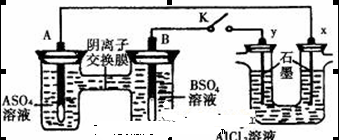
A.B的电极反应: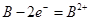
B.溶液中A2+浓度减小
C.y电极上有H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
D
解析试题分析:A、当 K 闭合时,在交换膜处 SO42一从右向左移动,说明A为负极,B为正极,B极上溶液中的金属阳离子得电子生成金属单质,电极反应式为B2++2eˉ═B,故A错误;B、当 K 闭合时,在交换膜处 SO42-从右向左移动,说明A为负极,B为正极,原电池中负极A上金属失电子发生氧化反应,生成金属阳离子进入溶液导致溶液中(A2+)浓度增大,故B错误;C、右边装置中连接B的y极为阳极,连接A的x极为阴极,电解池工作时,y极上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,故C错误;D、右边装置中y极上发生的电极反应式为2Cl--2e-=Cl2↑,x极上发生的电极反应式为2H++2e-=H2↑,由于氢离子放电而氢氧根离子不放电导致溶液呈碱性,铝离子和氢氧根离子反应生成难溶性的氢氧化铝,氢氧化铝和氢氧化钠反应生成可溶性的偏铝酸钠,故D正确。
考点:原电池和电解池的工作原理

利用如图所示装置可以模拟铁的电化学防护。下列说法不正确的是 ( )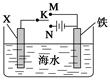
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀 |
| B.若X为锌棒,开关K置于M处,铁极发生氧化反应 |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀 |
| D.若X为碳棒,开关K置于N处,X极发生氧化反应 |
有关电化学原理的推断正确的是
| A.金属腐蚀就是金属原子失去电子被还原的过程 |
| B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e→4OH- |
| C.氯碱工业中,阳极发生的反应为:2Cl-–2e→Cl2↑ |
| D.镀锌铁皮的镀层损坏后,铁更容易腐蚀 |
银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。有关说法正确的是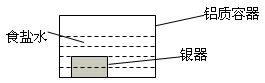
| A.该处理过程中电能转化为化学能 |
| B.银器为正极,Ag2S还原为单质银 |
| C.Ag2S溶解于食盐水生成了AgCl |
| D.铝质容器为阳极,其质量变轻 |
利用下图装置电解硫酸铜溶液,下列说法正确的是
| A.b电极上发生氧化反应 |
| B.该装置能将化学能转变成电能 |
| C.电解质溶液中Cu2+从b电极向a电极迁移 |
| D.若a为铜,则a的电极反应式为:Cu-2e-=Cu2+ |
下列关于下图装置的说法正确的是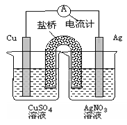
| A.银电极是负极 |
| B.铜电极上发生的反应为Cu-2e-=Cu2+ |
| C.外电路中的电子是从银电极流向铜电极。 |
| D.该装置能将电能转化为化学能 |
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是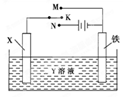
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲 阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小 |
下图为一原电池装置,下列叙述中正确的是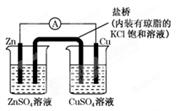
| A.铜是阳极,铜片上有气泡产生 |
| B.盐桥中的K+ 移向ZnSO4溶液 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |
下列有关铜锌原电池(如图)的叙述正确的是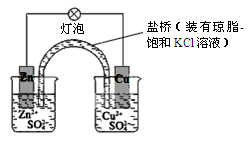
| A.正极反应为Zn-2e-=Zn2+ |
| B.电池反应为Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.取下盐桥,原电池仍可工作 |